PGS TS Nguyễn Nghiêm Luật - Bệnh viện Đa khoa MEDLATEC
30/09/2022 | Ung thư thận: các dấu ấn sinh học huyết thanh và nước tiểu, sinh thiết lỏng, các thay đổi phân tử và điều trị đích 06/05/2022 | Bệnh nhân ung thư thận sống được bao lâu? Kinh nghiệm chăm sóc thế nào? 15/03/2022 | Ung thư thận có di truyền không? 16/03/2021 | Ung thư thận: cơ chế sinh bệnh và dấu hiệu điển hình
Ung thư thận là bệnh mà các tế bào thận trở nên ác tính và phát triển mất kiểm soát, tạo thành một khối u. Ung thư biểu mô tế bào thận (RCC) là loại ung thư thận phổ biến nhất.
1) Các nguyên nhân và yếu tố nguy cơ: nguyên nhân chính xác của ung thư thận hiện chưa được biết nhưng một số yếu tố nguy cơ của ung thư thận có thể bao gồm: hút thuốc lá, béo phì, huyết áp cao, tiền sử gia đình bị ung thư thận, hóa chất tiếp xúc tại nơi làm việc như trichloroethylene, giới tính (nam giới), chủng tộc (Châu Phi), một số loại thuốc như acetaminophen, bệnh thận tiến triển, các yếu tố nguy cơ về gen và di truyền, ung thư thận gia đình, bệnh xơ cứng củ, ...
2) Các dấu hiệu và triệu chứng: ung thư thận thường không có các dấu hiệu hoặc triệu chứng trong giai đoạn đầu của bệnh. Theo thời gian, các dấu hiệu và triệu chứng có thể phát triển, bao gồm: đi tiểu ra máu, đau lưng hoặc một bên không biến mất, chán ăn, sụt cân không rõ nguyên nhân, mệt mỏi, thiếu máu, sưng mắt cá chân hoặc chân và sốt.
3) Các dấu ấn sinh học: đến nay, mặc dù không có một dấu ấn khối u nào được sử dụng trong sàng lọc ung thư thận, nhưng một số dấu ấn sinh học có thể được sử dụng để hỗ trợ chẩn đoán, tiên lượng, theo dõi tái phát, di căn hoặc đáp ứng điều trị. Các dấu ấn sinh học trong huyết thanh có thể gồm: TRAF-1, Hsp27, các protein gây viêm, các phân tử liên quan đến quá trình apoptosis, các phân tử liên quan đến vi môi trường khối u, và các loại khác. Các dấu ấn sinh học trong nước tiểu có thể gồm: NMP-22, NGAL, KIM-1, MMPs, AQP-1 và PLIN2.
4) Các dấu ấn sinh thiết sinh thiết lỏng: sinh thiết lỏng là việc lấy mẫu và phân tích các mô sinh học không rắn, chủ yếu là máu. Các chất phân tích quan trọng trong máu tuần hoàn như DNA khối u lưu thông (ctDNA), các tế bào khối u lưu thông (CTCs), các protein, các chất chuyển hóa của khối u, các RNA lưu hành và các túi ngoại bào có thể là dấu ấn sinh học tiềm năng để chẩn đoán, tiên lượng và theo dõi đáp ứng điều trị trong ung thư biểu mô tế bào thận.
5) Các thay đổi phân tử và điều trị đích: tám gen đột biến chủ yếu trong RCC gồm VHL, PBRM1, SETD2, BAP1, KDM5C, TP53, MTOR và PTEN. Các thuốc điều trị đích được sử dụng để điều trị ung thư thận gồm: các thuốc ức chế yếu tố tăng trưởng nội mô mạch máu (VEGF), các thuốc ức chế tyrosine kinase (TKIs), các thuốc ức chế rapamycin động vật có vú (mTOR) và các thuốc ức chế điểm kiểm soát miễn dịch (ICIs).
*
Kidney cancer: serum and urine biomarkers, liquid biobsy, molecular alterations and targeted therapy
Luat Nghiem Nguyen
MEDLATEC General Hospital
Kidney cancer is a disease in which kidney cells become malignant and grow out of control, forming a tumor. Renal cell carcinoma (RCC) is the most common type of kidney cancer.
1) Causes and risk factors: the exact cause of kidney cancer is unknown but several risk factors for kidney cancer may include: smoking, obesity, high blood pressure, family history of kidney cancer, workplace exposures such as trichloroethylene, gender (men), race (African), certain medicines such as acetaminophen, advanced kidney disease, genetic and hereditary risk factors, familial renal cancer, tuberous sclerosis, ...
2) Signs and symptoms: Kidney cancer usually doesn't have signs or symptoms in its early stages. In time, signs and symptoms may develop, including: blood in urine, pain in back or side that doesn't go away, loss of appetite, unexplained weight loss, fatigue, anemia, swelling in ankles or legs, and fever.
3) Biomarkers in serum and urine: recently, although there are no specific tumor markers used in kidney cancer screening, some markers can be used to assist in making a diagnosis, prognosis, monitoring recurrence, metastasis or treatment response. Biomarkers in serum may include: TRAF-1, Hsp27, inflammatory proteins, molecules involved in apoptosis, molecules related to tumor microenvironment, and miscellaneous. Bioarkers in in urine may include: NMP-22, NGAL, KIM-1, MMPs), AQP-1 and PLIN2.
4) Liquid biopsy biomarkers: a liquid biopsy is the sampling and analysis of non-solid biological tissue, primarily blood. The key liquid biobsy-based biomarkers such as circulating tumor DNA (ctDNA), circulating tumor cells (CTCs), proteins, oncometabolites, circulating RNA and exosomes that may be potential biomarkers for diagnosis, prognosis and monitoring response to treatment in renal cell carcinoma.
5) Molecular alterations and targeted therapy: the main eight mutated genes in RCC including VHL, PBRM1, SETD2, BAP1, KDM5C, TP53, MTOR and PTEN. The targeted drugs used to treat kidney cancer may include: vascular endothelial growth factor (VEGF) inhibitors, tyrosine kinase inhibitors (TKIs), mammalian target of rapamycin (mTOR) inhibitors and immune checkpoint inhibitors (ICIs).
*
Ung thư thận là một bệnh bắt đầu từ thận, xảy ra khi các tế bào khỏe mạnh ở một hoặc cả hai thận phát triển ngoài tầm kiểm soát và hình thành một khối u (tumor).
Theo cơ quan nghiên cứu ung thư Globocan thuộc Tổ chức Y tế Thế giới (WHO) [12], trong năm 2020, trên thế giới có 431.288 ca mắc ung thư thận, xếp thứ 15, chiếm tỷ lệ 2,2% và nguy cơ chung là 0,62 với 179.368 ca tử vong, xếp thứ 15, chiếm tỷ lệ 1,8% và nguy cơ tử vong chung là 0,20. Cũng theo Globocan [11], trong năm 2020, Ở Việt Nam có 2.435 ca mắc ung thư thận, xếp thứ 16, chiếm tỷ lệ 1,3% và nguy cơ chung là 0,23 với 1.130 ca tử vong, xếp thứ 16, chiếm tỷ lệ 0,92% và nguy cơ tử vong chung là 0,11.
Hình 1. Thận khỏe mạnh (bên trái) và thận bị ung thư (bên phải). Nguồn: www.irhto.com
Ung thư biểu mô tế bào thận (renal cell carcinoma: RCC) là loại phổ biến nhất của ung thư thận, chiếm khoảng 80%-90% trong tất cả các khối u các tính của thận, RCC có thể được phân loại thành 3 phân nhóm mô học chính: RCC tế bào sáng (clear-cell RCC: ccRCC 70-80%), RCC nhú (papillary RCC: pRCC, 10-15%), và RCC tế bào kỵ màu (chromophobe RCC: chRCC, 5- 10%), ngoài ra còn các kiểu phụ hiếm gặp như RCC ống góp (collecting duct RCC: cdRCC) và RCC sarcoma (sarcomatoid RCC: srRCC) [5, 6].
Một số ung thư thận có được phát hiện khá sớm khi chúng còn giới hạn ở thận, nhưng phần lớn ung thư thận chỉ được phát hiện ở giai đoạn tiến triển, bởi vì nó có thể phát triển khá lớn mà không gây ra dấu hiệu hoặc triệu chứng gì và cũng do thận nằm sâu bên trong cơ thể nên không thể nhìn thấy hoặc sờ thấy các khối u nhỏ ở thận khi khám sức khỏe. Cho đến nay chưa có xét nghiệm nào được khuyến cáo để sàng lọc ung thư thận ở những người không có nguy cơ.
Trong bài viết này, nguyên nhân và các yếu tố nguy cơ, các dấu hiệu và triệu chứng, các dấu ấn sinh học huyết thanh và nước tiểu, các dấu ấn sinh học dựa trên sinh thiết lỏng, các thay đổi phân tử và điều trị đích sẽ được trình bày.
1. Nguyên nhân và các yếu tố nguy cơ
1.1. Các nguyên nhân
Mặc dù một số yếu tố nguy cơ có thể làm tăng nguy cơ phát triển ung thư biểu mô tế bào thận, nhưng nguyên nhân gây nên ung thư thận hiện vẫn chưa được rõ hoàn toàn [1]. Các nguyên nhân gây nên ung thư thận có thể gồm:
1) Các thay đổi (đột biến) trong gen
Ung thư có thể do đột biến DNA, kích hoạt các gen sinh ung thư (oncogenes) hoặc tắt các gen ức chế khối u (tumor suppressor genes), dẫn đến các tế bào phát triển ngoài tầm kiểm soát. Những thay đổi ở nhiều gen khác nhau thường cần thiết để gây ra ung thư thận.
2) Các đột biến gen di truyền (inherited gene mutations)
Một số thay đổi DNA di truyền có thể xảy ra trong một số gia đình và làm tăng nguy cơ ung thư thận. Các xét nghiệm di truyền đặc biệt có thể phát hiện một số đột biến gen liên quan đến các hội chứng di truyền này. Nếu một người có tiền sử gia đình bị ung thư thận hoặc các bệnh ung thư khác có liên quan đến các hội chứng này, cần xét nghiệm di truyền.
3) Các đột biến gen mắc phải (acquired gene mutations)
Một số đột biến gen xảy ra trong suốt cuộc đời của một người và không bị di truyền. Chúng chỉ ảnh hưởng đến các tế bào đến từ tế bào bị đột biến ban đầu. Những thay đổi DNA này được gọi là đột biến gen mắc phải [1].
1.2. Các yếu tố nguy cơ
Một số yếu tố nguy cơ khiến một người dễ bị ung thư thận, có thể gồm:
1) Hút thuốc lá. Việc hút thuốc lá làm tăng nguy cơ phát triển ung thư biểu mô tế bào thận.
2) Béo phì. Những người quá cân có nguy cơ phát triển ung thư, do béo phì có thể gây ra những thay đổi một số hormon nhất định, có thể dẫn đến ung thư biểu mô tế bào thận.
3) Huyết áp cao. Nguy cơ ung thư thận cao hơn ở những người bị huyết áp cao. Nguy cơ này dường như không giảm ngay cả khi một người đang điều trị huyết áp cao.
4) Tiền sử gia đình. Những người có tiền sử gia đình bị ung thư biểu mô tế bào thận (không phải di truyền) có nguy cơ mắc bệnh ung thư này cao hơn.
5) Tiếp xúc với hóa chất. Việc tiếp xúc với một số chất tại nơi làm việc, chẳng hạn như với trichloroethylene, có thể làm tăng nguy cơ ung thư biểu mô tế bào thận.
6) Giới tính. Ung thư biểu mô tế bào thận phổ biến ở nam giới gấp đôi so với nữ giới, có thể do nam giới thường hút thuốc và dễ tiếp xúc với hóa chất gây ung thư tại nơi làm việc hơn.
7) Chủng tộc. Người Mỹ gốc Phi có tỷ lệ ung thư biểu mô tế bào thận cao hơn một chút so với người da trắng, lý do chưa rõ ràng.
8) Một số loại thuốc. Một số nghiên cứu gợi ý rằng acetaminophen, một loại thuốc giảm đau, có thể liên quan đến việc tăng nguy cơ ung thư biểu mô tế bào thận.
9) Bệnh thận tiến triển. Những người bị bệnh thận giai đoạn cuối, đặc biệt là những người được lọc máu, có nguy cơ mắc ung thư biểu mô tế bào thận cao hơn.
10) Các yếu tố nguy cơ về gen và di truyền (genetic and hereditary risk factors)
Một số người thừa hưởng các gen có thể làm tăng khả năng phát triển một số loại ung thư. DNA trong mỗi tế bào một người nhận được từ cha mẹ của họ có thể có những thay đổi khiến họ có nguy cơ này, những người này nên được chụp CT để phát hiện khối u thận.
Ngoài ra, những người có các tình trạng dưới đây có nguy cơ mắc ung thư thận cao hơn, mặc dù họ chỉ chiếm một phần nhỏ các trường hợp nói chung, đó là:
1) Bệnh von Hippel-Lindau, do đột biến ở gen VHL.
2) Ung thư biểu mô tế bào thận nhú di truyền, liên quan đến những thay đổi ở gen MET.
3) Ung thư biểu mô tế bào thận-leiomyoma di truyền, liên quan đến những thay đổi ở gen FH.
4) Hội chứng Birt-Hogg-Dube (BHD), do đột biến ở gen FLCN.
5) Ung thư thận gia đình, do khiếm khuyết ở gen SDHB và SDHD.
6) Hội chứng Cowden, có liên quan đến những thay đổi ở gen PTEN.
7) Bệnh xơ cứng củ (tuberous sclerosis), do các khiếm khuyết ở gen TSC1 và TSC2 [1, 6].
2. Các dấu hiệu và triệu chứng ung thư thận
Ung thư thận giai đoạn đầu thường không gây ra bất kỳ dấu hiệu hoặc triệu chứng nào, nhưng có thể xuất hiện ở những ung thư lớn hơn. Một số dấu hiệu và triệu chứng của ung thư thận có thể bao gồm:
- Có máu trong nước tiểu
- Đau thắt lưng một bên (không do chấn thương)
- Có một khối u ở bên hông hoặc lưng dưới
- Mệt mỏi
- Ăn mất ngon
- Giảm cân không do ăn kiêng
- Sốt không do nhiễm khuẩn và không biến mất
- Thiếu máu (số lượng hồng cầu thấp)
Những dấu hiệu và triệu chứng này có thể do ung thư thận (hoặc một loại ung thư khác), nhưng cũng có thể do các bệnh lành tính gây ra. Ví dụ, máu trong nước tiểu thường là do nhiễm khuẩn bàng quang, đường tiết niệu hoặc sỏi thận [1].
3. Các dấu ấn sinh học huyết thanh và nước tiểu
3.1. Các dấu ấn sinh học huyết thanh
Đến nay, không có dấu ấn sinh học khối u huyết thanh nào có khả năng sàng lọc để phát hiện sớm ung thư thận ngoài việc phát hiện tình cờ bằng chẩn đoán hình ảnh. Các dấu ấn sinh học chỉ có vai trò hỗ trợ chẩn đoán, tiên lượng và theo dõi hiệu quả điều trị ung thư thận [7, 8].
3.1.1. Yếu tố hoại tử khối u liên quan đến thụ thể-1 (TRAF-1)
Yếu tố hoại tử khối u liên quan đến thụ thể-1 TRAF-1 (tumor necrosis factor receptor-associated factor-1) là một protein có liên quan đến việc điều hòa sự tồn tại, tăng sinh, biệt hóa và đáp ứng stress (stress responses) của tế bào. Nồng độ TRAF-1 huyết thanh ở bệnh nhân ung thư biểu mô tế bào thận tăng một cách có ý nghĩa so với huyết thanh đối chứng [9].
3.1.2. Protein sốc nhiệt 27 (Hsp27)
Tình trạng thiếu oxy, đối với chứng viêm hoặc stress oxy hóa, là một trong những stress môi trường chính có khả năng kích hoạt sự khởi phát và tiến triển của khối u. Protein sốc nhiệt 27 (Hsp27 heat shock protein) có thể gây tình trạng phosphoryl hóa quá mức (hyperphosphoryl) ở nhiều loại ung thư. Nồng độ protein sốc nhiệt Hsp27 có thể tăng trong cả huyết thanh và nước tiểu bệnh nhân ung thư biểu mô tế bào thận [7].
3.1.3. Các protein viêm (inflammatory proteins)
1) Amyloid A (serum amyloid A: SAA). SAA là dấu ấn sinh học tiềm năng mới cho ung thư biểu mô tế bào thận, thường tăng tương quan thuận với giai đoạn khối u.
2) Protein phản ứng C (CRP). CRP thường tăng trong vòng vài giờ sau khi có sự kích thích của viêm (nhiễm khuẩn, chấn thương, nhồi máu, bệnh tự miễn dịch hoặc ác tính). Sự tăng nồng độ CRP huyết thanh ở bệnh nhân ung thư biểu mô tế bào thận có liên quan đến kích thước khối u và mức độ nặng của bệnh, với tỷ lệ sống sót kém.
3) Gamma-glutamyl transferase (GGT). GGT là một enzym tham gia vào quá trình chuyển hóa glutathione và thường tăng lên đáng kể ở bệnh nhân ung thư. GGT là một yếu tố tiên lượng độc lập mới trong quản lý bệnh nhân ung thư biểu mô tế bào thận [7].
3.1.4. Các phân tử tham gia vào sự chết tế bào theo chương trình
Các tế bào ung thư thường tránh được quá trình chết tế bào theo chương trình (apoptosis) để sinh một cách mất kiểm soát. Các phân tử tham gia vào sự chết tế bào theo chương trình gồm:
1) Phối tử liên quan đến quá trình chết theo yếu tố hoại tử khối u (tumor necrosis factor-related apoptosis-inducing ligand: TRAIL). TRAIL được xem là một đích hứa hẹn cho điều trị đích ung thư vì nó có thể thúc đẩy sự chết tế bào theo chương trình (apoptosis) ở các tế bào khối u nhưng không tác động ở các tế bào bình thường. Sự giảm mạnh nồng độ TRAIL huyết thanh ở bệnh nhân RCC trước phẫu thuật có liên quan đến tỷ lệ sống sót thấp hơn của bệnh nhân.
2) Cytokeratins (CK): CK là một sản phẩm có nguồn gốc từ quá trình apoptosis, được giải phóng vào máu ở dạng nguyên vẹn hoặc được phân cắt bởi caspase. Nồng độ M65 (dạng nguyên vẹn của cytokeratin 18) trong huyết thanh tăng một cách có ý nghĩa ở bệnh nhân bị RCC di căn so với ở người khỏe mạnh. Nồng độ M65 huyết thanh cũng có thể giúp dự đoán khả năng sống sót không tiến triển (progression-free survival: PFS) ở bệnh nhân RCC. Khả năng sống sót không tiến triển (PFS) trung bình của bệnh nhân RCC có nồng độ M65 ≤313,6 U/L tốt hơn so với bệnh nhân có nồng độ M65 >313,6 U/L (P=0,03) [7].
3.1.5. Các phân tử liên quan đến vi môi trường khối u
Sự phát triển của khối u được kiểm soát chặt chẽ bởi vi môi trường (microenvironment) của nó, trong đó các thành phần như các nguyên bào sợi (fibroblasts) và các đại thực bào (macrophages), các yếu tố tăng trưởng (growth factors), các cytokine và các phân tử sinh mạch máu (angiogenic molecules) kích thích khối u tiến triển. Tình trạng thiếu oxy (hypoxia) một yếu tố thiết yếu đặc trưng cho môi trường của tế bào ung thư. Tình trạng thiếu oxy thúc đẩy sự hoạt hóa của các yếu tố phiên mã có khả năng cảm ứng bởi sự thiếu oxy (hypoxia-inducible transcriptional factors) như HIF-1α và HIF-1β, giúp cải thiện sự biểu hiện của các yếu tố tiền di truyền như VEGF. Hơn nữa, các đột biến di truyền của các protein liên quan đến sự ổn định của các yếu tố HIF, chẳng hạn như protein Von Hippel-Lindau (VHL), được xem là các sự kiện chính gây ra phần lớn ung thư biểu mô tế bào thận tế bào sáng.
Ngoài protein VHL bị thay đổi trong 85% trường hợp ung thư biểu mô tế bào thận, yếu tố gây thiếu oxy prolyl hydroxylase-3 (PHD3) cũng thường bị biểu hiện quá mức ở mô ung thư thận. Nồng độ kháng thể kháng PHD3 (PHD3 Ab) huyết thanh bệnh nhân RCC cao hơn so với người khỏe mạnh, giảm dần sau phẫu thuật cắt bỏ khối u thận. Ngoài ra, tình trạng thiếu oxy cũng có thể thúc đẩy sự biểu hiện của một số enzym như cacbonic anhydrase (CA). Mức độ carbonic anhydrase IX (CA IX) cao hơn ở cả mô và huyết thanh bệnh nhân ung thư biểu mô tế bào thận tế bào sáng (ccRCC) so với bệnh nhân không bị ung thư loại này [3, 7].
3.1.6. Các dấu ấn sinh học khác
1) Pyruvate kinase isoenzyme loại M2 (TuM2-PK) và thymidine kinase 1 (TK1). Nồng độ TuM2-PK và TK1 huyết thanh cao hơn đáng kể ở bệnh nhân RCC so với nhóm đối chứng và có sự tương quan thuận với giai đoạn hoặc mức độ khối u.
2) Proteasome 20S. Trong RCC, người ta thấy có sự thay đổi cơ chế sinh lý của hệ thống proteasome ubiquitin (UPS). Sự tăng nồng độ proteasome 20S huyết thanh ở bệnh nhân RCC có liên quan chặt với khả năng sống sót theo bệnh cụ thể (disease-specific survival: DSS) của họ.
3) Calci máu. Khoảng 10% b có sự vôi hóa ở phúc mạc. Vì vậy, việc đo nồng độ calci trong máu là một phân tích chính được sử dụng để chẩn đoán lâm sàng RCC. Sự tăng calci huyết trong RCC là do thay đổi chuyển hóa của các chất ức chế hoặc hoạt hóa quá trình calci hóa, chẳng hạn như fetuin A, osteopontin (OPN) và osteoprotegerin. Nồng độ OPN huyết thanh tăng rõ rệt ở bệnh nhân RCC thể nhú so với các RCC khác và tương quan thuận với giai đoạn TNM [7].
3.2. Các dấu ấn sinh học nước tiểu
Các dấu ấn sinh học nước tiểu trong ung thư biểu mô tế bào thận có thể gồm:
3.2.1. Protein nền nhân-22 (NMP-22)
Protein nền nhân -22 (nuclear matrix proteins-22: NMP-22). NMP-22 có vai trò quan trọng trong quá trình sao chép DNA, phiên mã RNA và điều hòa sự biểu hiện gen. Các đặc điểm của protein nền hạt nhân làm cho chúng trở thành dấu ấn tiềm năng của các tế bào ác tính liên quan đến sự phân bố bất thường của vật liệu di truyền và của sự tăng phân bào (mitosis). Nồng độ protein nền nhân -22 (NMP-22) nước tiểu trước phẫu thuật ở bệnh nhân RCC cao hơn đáng kể so với ở bệnh thận lành tính.
3.2.2. Lipocalin liên kết với neutrophil gelatinase (NGAL)
Lipocalin 2, còn được gọi là lipocalin liên kết với neutrophil gelatinase (neutrophil gelatinase-associated lipocalin: NGAL), là một thành viên nổi bật của gia đình lipocalin. NGAL là một protein có khối lượng phân tử 25 kDa, liên kết cộng hóa trị với metalloproteinase-9 nền (MMP-9) của các bạch cầu trung tính. NGAL là một dấu hiệu sinh học của tổn thương ống thận và được biểu hiện trong một số khối u thận và sự biểu hiện cao của nó có liên quan đến mức độ mô học cao hơn của RCC tế bào sáng và RCC thể nhú, so với u biểu mô hạt (oncocytoma) và ung thư biểu mô đường tiết niệu (urothelial carcinoma). Sự bài tiết NGAL qua nước tiểu có khả năng xảy ra song song với sự tổn thương ống thận cùng với sự tăng tổng hợp mới (de novo) hoặc sự ngăn cản tái hấp thu NGAL. Ở bệnh nhân RCC tế bào sáng, nồng độ NGAL trong nước tiểu cao hơn so với nồng độ NGAL trong nước tiểu của nhóm đối chứng [7].
3.2.3. Phân tử chấn thương thận-1 (KIM-1)
Phân tử tổn thương thận-1 KIM-1 (kidney injury molecule-1). Mặc dù KIM-1 có khả năng giúp chẩn đoán ung thư thận, nhưng nó cũng có thể tăng trong nhiều loại tổn thương thận, do đó độ đặc hiệu chẩn đoán ung thư thận bị hạn chế [7].
3.2.4. Các metalloproteinase nền (MMPs)
Các metalloproteinase nền (matrix metalloproteinases: MMPs) là một nhóm các endopeptidase chứa kẽm có vai trò trong việc phân hủy tất cả các thành phần nền ngoại bào (extracellular matrix components: ECM). Chúng có liên quan đến việc giải phóng trực tiếp và gián tiếp các yếu tố tăng trưởng, sự hình thành và phát triển của khối u. Đặc biệt, MMP-2 và MMP-9 có liên quan đến kiểu hình ác tính (malignant phenotype) của tế bào khối u và có thể là dấu ấn của khối u ác tính [7].
3.2.5. Aquaporin-1 (AQP-1) và Perilipin 2 (PLIN2)
Aquaporin-1 (AQP-1) và protein liên quan đến biệt hóa tế bào mỡ (adipocyte-differentiation-related protein), gọi là perilipin 2 (PLIN2), thường bị biểu hiện quá mức ở mô khối u thận. Nồng độ AQP-1 và PLIN2 trong nước tiểu thường tăng ở những bệnh nhân bị ung thư biểu mô tế bào sáng (ccRCC) và ung thư biểu mô tế bào nhú (papillary RCC) so với nhóm đối chứng. Nồng độ trong nước tiểu của hai dấu ấn này không bị ảnh hưởng bởi các bệnh thận lành tính, như ở bệnh thận do đái tháo đường, nhiễm khuẩn đường tiết niệu hoặc viêm cầu thận, nên có khả năng phản ánh kích thước và giai đoạn khối u [7].
4. Các dấu ấn sinh học sinh thiết lỏng
Các dấu ấn sinh học khối u có thể thu được từ sinh thiết lỏng (liquid biopsy) từ máu, là một phương pháp xâm lấn tối thiểu, có thể được sử dụng trong chẩn đoán, dự đoán và tiên lượng ung thư thận, gồm: các tế bào khối u lưu thông (circulating tumor cells: CTCs), DNA khối u lưu thông (circulating tumor DNA: ctDNA), các RNA không mã hóa (non-coding RNA), các exosom (exosomes) và DNA methyl hóa. Sinh thiết chất lỏng có thể dễ dàng lặp lại để thực hiện các xét nghiệm nối tiếp về ung thư, giúp phát hiện tái phát và đáp ứng với điều trị, làm giảm chi phí quản lý và là một tiến bộ trong y học cá thể hóa.
Các dấu ấn sinh học dựa trên sinh thiết lỏng trong ung thư biểu mô tế bào thận và các công nghệ có thể được sử dụng để phân tích chúng được thể hiện ở Hình 2.
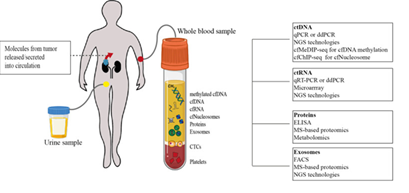
Hình 2. Các dấu ấn sinh học dựa trên sinh thiết lỏng trong ung thư biểu mô tế bào thận và các công nghệ có thể được sử dụng để phân tích chúng (Lakshminarayanan H, 2020 [4]). Ghi chú: cfDNA (cell-free DNA): DNA không tế bào; cfRNA (cell-free RNA): RNA không tế bào; cfNucleosomes (cell-free nucleosomes): các nucleosomes không tế bào; CTCs (circulating tumor cells): các tế bào khối u lưu thông; ctDNA (circulating tumor DNA): DNA khối u lưu thông; qPCR (quantitative polymerase chain reaction): phản ứng chuỗi polymerase định lượng; ddPCR (droplet digital PCR): phản ứng chuỗi polymerase kỹ thuật số dạng giọt; NGS (next-generation sequencing): giải trình tự thế hệ tiếp theo; cfMeDIP-seq (droplet digital polymerase chain reaction): giải trình tự kết tủa miễn dịch DNA metyl hóa không tế bào; cfChIP-seq (cell-free methylated DNA immunoprecipitation sequencing): giải trình tự kết tủa miễn dịch nhiễm sắc thể không tế bào; ctRNA (circulating tumor RNA): RNA khối u lưu thông; ELISA (enzyme-linked immunosorbent assay): xét nghiệm hấp thụ miễn dịch liên kết với enzym; MS (mass spectrometry): khối phổ; FACS (fluorescence-activated cell sorting): phân loại tế bào kích hoạt huỳnh quang.
4.1. Các DNA khối u tuần hoàn
DNA khối u tuần hoàn (circulating tumor DNA: ctDNA) từ khối u thận vào máu tuần hoàn có thể giúp xác định bộ gen khối u mà không cần sinh thiết mô. Việc sử dụng DNA không tế bào (cell-free DNA: cfDNA) có thể giúp dự đoán và theo dõi sự tiến triển ung thư biểu mô tế bào thận di căn (metastatic renal cell carcinoma: mRCC). Nồng độ cfDNA ở bệnh nhân RCC tiến triển hoặc di căn cao hơn rõ rệt so với ở người khỏe mạnh và ở bệnh nhân khối u còn khu trú [4].
4.2. Các tế bào ung thư lưu thông
Trong một nghiên cứu trên 457 mẫu sinh thiết lỏng từ 104 bệnh nhân bị ung thư biểu mô tế bào thận di căn (mRCC), Bootsma M và các cộng sự, 2022 [2] thấy rằng số lượng các tế bào ung thư lưu thông (circulating tumor cells: CTCs) giảm dần trong suốt quá trình điều trị. Những bệnh nhân có số lượng các tế bào ung thư lưu thông ở một phần tư cao nhất (>0,12 CTCs/mL) có thời gian sống chung (OS) ngắn hơn một cách rất rõ rệt (trung bình 17,0 so với 21,1 tháng, P<0,001).
4.2. Các protein và các chất chuyển hóa của ung thư
1) Nồng độ phân tử tổn thương thận 1 (KIM1) được phát hiện là tăng rõ rệt ở bệnh nhân RCC, đặc biệt tăng gần gấp 7 lần ở bệnh nhân RCC di căn (mRCC). KIM1 lưu hành có độ đặc hiệu 83% trong việc phát hiện khối u giai đoạn đầu và tăng lên 97% ở các giai đoạn sau.
2) HIG2, một protein cảm ứng thiếu oxy, đã tăng lên khoảng 3 lần trong huyết tương của bệnh nhân RCC và giảm mạnh sau khi phẫu thuật cắt bỏ thận.
3) CAIX, một trong những đích nổi bật nhất của con đường VHL-HIF, cũng tăng rõ rệt trong huyết tương của bệnh nhân ccRCC so với nhóm đối chứng.
4) IMP3, nồng độ IMP3 tăng được thấy ở bệnh nhân RCC và tương quan với sự di căn xa.
5) CD27, cũng tăng trong huyết thanh của bệnh nhân ccRCC [4].
4.4. Các RNA tuần hoàn và các túi ngoại bào
Các RNA không tế bào lưu thông (circulating cfRNA) có thể được phóng thích từ các túi ngoại bào (exosomes). Các RNA mã hóa như các RNA thông tin (mRNA), các RNA nhỏ không mã hóa như miRNA (microRNA) là phân tử miRNA không mã hóa, dài khoảng 21- 25 nucleotide và các RNA không mã hóa dài (long non-coding RNAs: lncRNA), dài trên 200 nucleotide, là những dấu ấn sinh học sinh thiết lỏng tiềm năng. Nồng độ miR-210 trong huyết thanh của bệnh nhân ccRCC thường tăng, giảm sau khi phẫu thuật cắt bỏ thận. Các miRNA lưu thông có liên quan đến tiên lượng mRCC gồm miR-122-5p, miR-206 và miR-221, miR-221, có sự tương quan rõ rệt với tỷ lệ sống sót thấp hơn. Sự kết hợp giữa miR-508-3p và miR-885-5p huyết thanh có thể giúp phân biệt RCC tế bào sáng (ccRCC) với các RCC khác [4].
5. Các thay đổi phân tử và điều trị đích
Ung thư biểu mô tế bào thận (RCC) thường kháng với hóa trị và xạ trị. Phẫu thuật cắt bỏ khối u ở giai đoạn khu trú vẫn là phương pháp điều trị chính. Các thuốc điều trị đích tác động bằng cách ngăn chặn các con đường tín hiệu (signaling pathways) quan trọng liên quan đến sự phát triển, sinh sôi và sự sinh mạch máu của khối u.
Các con đường tín hiệu trong ung thư biểu mô tế bào thận có thể gồm: 1) Các con đường tín hiệu sinh mạch máu (angiogenic signaling pathways); 2) Con đường tín hiệu PI3K/ AKT/ mTOR; 3) Con đường tín hiệu Wnt/ β-catenin; 4) Sự chuyển tiếp từ biểu mô sang trung mô (epithelial to mesenchymal transition: EMT); 5) Con đường tín hiệu HGF/ MET; 6) Các biến đổi gen và biểu sinh khác.
Các gen đột biến chủ yếu của ung thư biểu mô tế bào thận theo Danh mục đột biến xôma trong ung thư (Catalogue of somatic mutations in cancer: COSMIC) gồm các gen: VHL (Von Hippel-Lindau gene), protein polybromo ‑ 1 (PBRM1), histone ‑ lysine N methyltransferase SETD2, protein liên kết BRCA1 ‑ 1 (BAP1), lysine ‑ đặc hiệu demethylase 5C (KDM5C), TP53, mTOR và PTEN. Sự liên quan giữa tình trạng đột biến gen của VHL, PBRM1, SETD2 và BAP1 đã được xác nhận với các thông số bệnh lý lâm sàng cũng như thời gian sống thêm tổng thể.
Các đột biến ở một hoặc nhiều gen trên các con đường tín hiệu này có thể ảnh hưởng đến đáp ứng của khối u với điều trị. Các nghiên cứu cho thấy có nhiều sự thay đổi phân tử (gen và protein) trong ung thư thận, tuy nhiên, không phải sự thay đổi phân tử nào cũng được sử dụng để điều trị đích ung thư thận [5] (Hình 3).
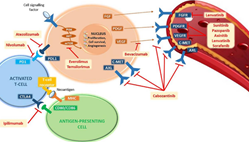
Hình 3. Các con đường tín hiệu chủ yếu liên quan đến cơ chế sinh mạch máu, sinh sôi và sống sót tế bào, và các phân tử đích trong điều trị đích ung thư biểu mô tế bào thận (Roberto M, 2021 [9]). Ghi chú: PD1 (programmed cell death-1 receptor): thụ thể chết tế bào được lập trình -1; PD-L1 (programmed death-ligand 1): phối tử chết được lập trình 1; CTLA4 (cytotoxic T-lymphocyte-associated protein 4): protein liên kết với tế bào lympho T gây độc tế bào 4; CD80 (cluster of differentiation 80): cụm biệt hóa 80; CD86 (cluster of differentiation 86): cụm biệt hóa 86; MHC (major histocompatibility complex): phức hợp tương hợp mô chính; PI3K: phosphatidylinositol-3-kinase; AKT (serine/threonine kinase 1): serine/threonine kinase 1; mTOR (mammalian target of rapamycin): đích động vật có vú của rapamycin; FGF (fibroblast growth factor): yếu tố tăng trưởng nguyên bào sợi; PDGF (platelet-derived growth factor): yếu tố tăng trưởng có nguồn gốc từ tiểu cầu; VEGF (vascular endothelial growth factor): yếu tố tăng trưởng nội mô mạch máu; cMET (mesenchymal epithelial transition factor): yếu tố chuyển tiếp biểu mô trung mô; AXL (AXL receptor tyrosine kinase): tyrosine kinase thụ thể AXL; FGFR (fibroblast growth factor receptor): thụ thể yếu tố tăng trưởng nguyên bào sợi; PDGFR (platelet-derived growth factor receptor): thụ thể yếu tố tăng trưởng có nguồn gốc từ tiểu cầu; VEGFR (vascular endothelial growth factor receptor): thụ thể yếu tố tăng trưởng nội mô mạch máu.
Các thuốc điều trị đích có vai trò đặc biệt quan trọng trong điều trị ung thư thận, khi hóa trị liệu không có hiệu quả. Các thuốc điều trị đích có thể được sử dụng trong các trường hợp:
1) Điều trị ung thư thận giai đoạn cuối: các thuốc điều trị đích có thể được sử dụng để điều trị ung thư thận giai đoạn cuối, có tác dụng thu nhỏ hoặc làm chậm sự phát triển của ung thư trong một thời gian, nhưng hầu như không có bất kỳ thuốc điều trị đích nào có khả năng chữa khỏi ung thư thận. Các thuốc điều trị đích thường được sử dụng riêng lẻ. Sự kết hợp của các thuốc điều trị đích có thể hữu ích hơn so với việc sử dụng một mình.
2) Điều trị bổ trợ sau phẫu thuật: điều trị bổ trợ (adjuvant therapy) là điều trị đích sau phẫu thuật. Thuốc điều trị đích sunitinib (Sutent) có thể được sử dụng sau khi phẫu thuật ở những người có nguy cơ cao ung thư tái phát, để giúp giảm nguy cơ ung thư tái phát [1].
Các thuốc điều trị đích ung thư biểu mô tế bào thận di căn đang được thử nghiệm lâm sàng chủ yếu gồm: các thuốc ức chế sự sinh mạch máu khối u (vascular endothelial growth factor (VEGF) inhibitors, các thuốc ức chế tyrosine kinase (tyrosine kinase inhibitors: TKIs), các thuốc ức chế mTOR (mTOR inhibitors) và các thuốc ức chế điểm kiểm soát miễn dịch (immune checkpoint inhibitors: ICIs) [10].
5.1. Các thuốc ức chế sự sinh mạch máu khối u
1) Bevacizumab. Bevacizumab là một kháng thể đơn dòng có tác dụng ức chế sự sinh mạch máu khối u (VEGF) đã được thử nghiệm đối chứng ngẫu nhiên mù đôi (double-blind randomized controlled trial: double-blind RCT) giai đoạn III: 53 bevacizumab 10 mg/kg mỗi 2 tuần với IFN 9 triệu đơn vị (MU) ba lần/ tuần so với IFN 9 MU ba lần/tuần với giả dược. Thời gian sống sót với bệnh không tiến triển (progression-free survival: PFS) là 10,2 tháng so với 5,4 tháng; thời gian sống sót chung (overall survival: OS) là 23,3 tháng so với 21,3 tháng. Thử nghiệm giai đoạn III không mù đôi ngẫu nhiên có đối chứng: 54,55 bevacizumab 10 mg/ kg/ 2 tuần với IFN-α 9 MU ba lần/tuần so với IFN-α 9 MU ba lần/ tuần. PFS: 8,5 so với 5,2 tháng; OS: 18,3 tháng so với 17,4 tháng [10].
5.2. Các thuốc ức chế enzym tyrosine kinase (TKI)
1) Sorafenib. Sorafenib là một thuốc phân tử nhỏ có tác dụng ức chế tyrosine kinase (TKI) (trên các con đường tín hiệu VEGFR1-3, PDGFβ, FMS-like tyrosine kinase 3, protein c-Kit và thụ thể RET). Thử nghiệm đối chứng ngẫu nhiên mù đôi giai đoạn II: tất cả bệnh nhân được điều trị sorafenib 400 mg×2 lần/ ngày trong 12 tuần. Ở tuần thứ 12, bệnh nhân có khối u nhỏ lại dưới 25% được ngẫu nhiên chọn tiếp tục sorafenib hoặc giả dược. PFS: 24 tuần so với 6 tuần. Thử nghiệm thuốc mù đôi giai đoạn III: sorafenib 400 mg×2 lần/ ngày so với giả dược. Kết quả: PFS: 5,5 so với 2,8 tháng; OS: 19,3 so với 15,9 tháng [1, 10].
2) Sunitinib. Sunitinib là một thuốc phân tử nhỏ có tác dụng ức chế tyrosine kinase (TKI) (trên các con đường tín hiệu VEGFR1-3, PDGFRα và β). Thử nghiệm giai đoạn II: 58 sunitinib 50 mg/ngày trong 4 tuần sau đó 2 tuần ngừng điều trị. Kết quả: PFS: 10,7 tháng; OS: 23,9 tháng. Thử nghiệm giai đoạn III đối chứng ngẫu nhiên (RCT): 59 sunitinib 50 mg/ ngày trong 4 tuần, so với IFN-α 3 MU ba lần/ tuần trong 1 tuần, 6 MU ba lần/ tuần trong 1 tuần, 9 MU ba lần/tuần sau đó. PFS: 11 so với 5 tháng; OS: 26,4 so với 21,8 tháng [1, 10].
3) Pazopanib. Pazopanib là một TKI (trên con đường tín hiệu VEGFR, PDGFR và protein c-Kit) Thử nghiệm đối chứng ngẫu nhiên (RCT) mù đôi pha III: 60-61 pazopanib 800 mg/ ngày so với giả dược. PFS: 9,2 so với 4,2 tháng; OS: 22,9 so với 20,5 tháng [1, 10].
4) Tivozanib. Tivozanib là một TKI (chất ức chế VEGFR1-3). Thử nghiệm giai đoạn III không kèm theo đối chứng ngẫu nhiên (RCT): 62 tivozanib 1,5 mg/ ngày trong 3 tuần, sau đó 1 tuần nghỉ so với sorafenib 400 mg hai lần/ ngày. PFS: 12,7 so với 9,1 tháng; OS: 28,8 so với 29,3 tháng [10].
5) Cabozantinib. Cabozantinib là một TKI (con đường tín hiệu VEGFR, MET và AXL). Thử nghiệm đối chứng ngẫu nhiên (RCT) giai đoạn III: 63,64 cabozantinib 60 mg/ ngày so với everolimus 10 mg/ ngày. PFS: 7,4 so với 3,8 thánga; OS: 21,4 so với 16,5 tháng. Thử nghiệm giai đoạn II không kèm theo đối chứng ngẫu nhiên (RCT): 65 cabozantinib 60 mg/ ngày so với sunitinib 50 mg/ ngày trong 4 tuần, sau đó là 2 tuần ngừng điều trị. PFS: 8,6 so với 5,3 tháng; OS: 26,6 so với 21,2 tháng [1, 10].
6) Lenvatinib. Lenvatinib là một TKI (VEGFR1-3, FGFR1-4, PDGFRα, KIT và RET). Thử nghiệm đối chứng ngẫu nhiên (RCT) giai đoạn II: 66 lenvatinib 24 mg/ ngày so với everolimus 10 mg/ ngày so với lenvatinib 18 mg/ ngày và everolimus 5 mg/ ngày. PFS: 7,7 so với 5,5 so với 14,6 tháng [1, 10].
7) Axitinib. Thử nghiệm giai đoạn III của axitinib đối chứng ngẫu nhiên (RCT): 67 axitinib 5 mg×2 lần/ ngày với liều tăng dần đến 10 mg×2 lần/ ngày so với sorafenib 400 mg×2 lần/ ngày. PFS: 8,3 so với 5,7 tháng; OS: 20,1 tháng so với 19,2 tháng [1, 10].
5.3. Các thuốc ức chế mTOR (mTOR inhibitors)
1) Temsirolimus. Temsirolimus là một thuốc ức chế mTOR (tiêm tĩnh mạch). Thử nghiệm đối chứng ngẫu nhiên (RCT) giai đoạn III: 68 IFNα 3 MU ba lần một tuần trong 1 tuần, 9 MU ba lần/ tuần trong 1 tuần, 18 MU ba lần/ tuần sau đó so với temsirolimus 25 mg/ tuần so với temsirolimus 15 mg/ tuần và IFNα 3 MU ba lần/ tuần trong 1 tuần và 6 MU ba lần/ tuần sau đó. PFS: 3,1 so với 5,5 so với 4,7 tháng; OS: 7,3 so với 10,9 so với 8,4 tháng [1, 10].
2) Everolimus. Everolimus là một thuốc ức chế mTOR (uống). Thử nghiệm đối chứng ngẫu nhiên (RCT) giai đoạn III mù đôi: 69 everolimus 10 mg/ ngày so với giả dược. PFS: 4,9 so với 1,9 tháng; OS: 14,8 so với 14,4 tháng [1, 10].
5.4. Các kháng thể đơn dòng ức chế điểm kiểm soát miễn dịch
Các protein điểm kiểm soát miễn dịch như protein gây chết theo chương trình-ligand 1 (programmed death-L1: PD-L1) trên bề mặt tế bào khối u và protein gây chết theo chương trình 1 (programmed death 1: PD-1) trên bề mặt các lympho T và kháng nguyên 4 liên kết tế bào lympho T độc tế bào (cytotoxic T-lymphocyte-associated antigen 4: CTLA-4) trên bề mặt các tế bào tua (dendritic cells) có tác dụng giúp các đáp ứng miễn dịch trong tầm kiểm soát. Sự gắn của PD-L1 vào PD1 giữ cho các lympho T độc tế bào không tiêu diệt các tế bào khối u. Sự khóa liên kết của PD-L1 với PD-1 bằng các thuốc ức chế điểm kiểm soát miễn dịch (immune checkpoint inhibitors: ICIs) như các thuốc ức chế PD-1 (PD-1 inhibitors), các thuốc ức chế PDL-1 (PDL-1 inhibitors) hoặc các thuốc ức chế CTLA-4 (CTLA-4 inhibitors) cho phép các lympho T độc tế bào tiêu diệt các tế bào khối u [10].
1) Nivolumab. Nivolumab là một kháng thể đơn dòng nhân tính hóa (humanised monoclonal immunoglobulin), có tác dụng ức chế điểm kiểm soát miễn dịch PD-1. Thử nghiệm giai đoạn II phân liều ngẫu nhiên mù đơn: nivolumab 0,3 mg/ kg hoặc 2 mg/ kg hoặc 10 mg/ kg mỗi 3 tuần. PFS: 2,7 so với 4,0 so với 4,2 tháng; OS: 18,2 so với 25,5 so với 24,7 tháng. Thử nghiệm đối chứng ngẫu nhiên (RCT) giai đoạn III: 20 nivolumab 3 mg/ kg/ 2 tuần so với everolimus 10 mg/ ngày. PFS: 4,6 so với 4,4 tháng; OS: 25,0 so với 19,6 tháng [10].
2) Ipilimumab. Ipilimumab cũng là một kháng thể đơn dòng nhân tính hóa, có tác dụng ức chế điểm kiểm soát miễn dịch CTLA-4. Thử nghiệm đối chứng ngẫu nhiên (RCT) giai đoạn III: 70 nivolumab 3 mg/ kg và ipilimumab 1 mg/ kg mỗi 3 tuần với bốn liều, tiếp tục với nivolumab 3 mg/ kg/ 2 tuần so với sunitinib 50 mg/ ngày/ 4 tuần. PFS: 11,6 so với 8,4 tháng [10].
Tóm lại, ung thư thận là bệnh mà các tế bào thận trở nên ác tính và phát triển mất kiểm soát, tạo thành một khối u. Nguyên nhân của ung thư thận vẫn chưa được biết nhưng một số yếu tố nguy cơ của ung thư thận có thể gồm: hút thuốc lá, béo phì, huyết áp cao, tiền sử gia đình bị ung thư thận, hóa chất tiếp xúc tại nơi làm việc như trichloroethylene, nam giới, chủng tộc (Châu Phi), một số loại thuốc như acetaminophen, bệnh thận tiến triển, các yếu tố nguy cơ về gen và di truyền, ung thư thận gia đình, bệnh xơ cứng củ, ... Các dấu hiệu và triệu chứng của ung thư thận có thể gồm: đi tiểu ra máu, đau lưng hoặc một bên không biến mất, chán ăn, sụt cân không rõ nguyên nhân, mệt mỏi, thiếu máu, sưng mắt cá chân hoặc chân và sốt. Hiện chưa có dấu ấn khối u huyết thanh nào có thể giúp sàng lọc ung thư thận nhưng một số dấu ấn có thể được sử dụng để đánh giá tiên lượng, theo dõi tái phát hoặc di căn và đáp ứng điều trị ung thư. Các dấu ấn sinh học huyết thanh có thể gồm TRAF-1, Hsp27, các protein gây viêm, các phân tử liên quan đến quá trình apoptosis, các phân tử liên quan đến vi môi trường khối u, … ; các dấu ấn sinh học nước tiểu có thể gồm NMP-22, NGAL, KIM-1, MMPs, AQP-1 và PLIN2. Các dấu ấn sinh học sinh thiết lỏng như DNA khối u lưu thông (ctDNA), các tế bào khối u lưu thông (CTCs), các protein, các chất chuyển hóa của khối u, các RNA lưu thông và các túi ngoại bào có thể giúp chẩn đoán, tiên lượng và theo dõi đáp ứng điều trị ung thư biểu mô tế bào thận. Về các thay đổi phân tử và điều trị đích: tám gen đột biến chủ yếu trong ccRCC gồm VHL, PBRM1, SETD2, BAP1, KDM5C, TP53, MTOR và PTEN. Các loại thuốc điều trị đích được sử dụng để điều trị ung thư thận gồm: các thuốc ức chế yếu tố tăng trưởng nội mô mạch máu (VEGF), các thuốc ức chế tyrosine kinase (TKIs), các thuốc ức chế rapamycin của động vật có vú (mTOR) và các thuốc ức chế điểm kiểm soát miễn dịch (ICIs).
Tài liệu tham khảo
1. American Cancer Society. Kidney Cancer. ACS 2021.
2. Bootsma M, McKay RR, Emamekhoo H, et al. Longitudinal Molecular Profiling of Circulating Tumor Cells in Metastatic Renal Cell Carcinoma. J Clin Oncol 2022 May 26; (in press).
3. Bratu O, Mischianu D, Marcu D, et al. Renal tumor biomarkers (Review). Exp Ther Med 2021 Nov; 22(5): 1297.
4. Lakshminarayanan H, Rutishauser D, Schraml P, Moch H, and Bolck HA. Liquid Biopsies in Renal Cell Carcinoma-Recent Advances and Promising New Technologies for the Early Detection of Metastatic Disease. Front Oncol 2020; 10: 582843.
5. Li F, Aljahdali IAM, Zhang R, et al. Kidney cancer biomarkers and targets for therapeutics: survivin (BIRC5), XIAP, MCL-1, HIF1α, HIF2α, NRF2, MDM2, MDM4, p53, KRAS and AKT in renal cell carcinoma. J Exp Clin Cancer Res 2021; 40: 254.
6. Mickley A, Kovaleva O, Kzhyshkowska J, and Gratchev A. Molecular and immunologic markers of kidney cancer-potential applications in predictive, preventive and personalized medicine. EPMA J 2015; 6: 20.
7. Pastore AL, Palleschi G, Silvestri L, et al. Serum and urine biomarkers for human renal cell carcinoma. Dis Markers 2015; 2015: 251403.
8. Petitprez F, Ayadi M, de Reyniès A, et al. Review of Prognostic Expression Markers for Clear Cell Renal Cell Carcinoma. Front Oncol 2021; 11: 643065.
9. Roberto M, Botticelli A, Panebianco M, et al. Metastatic Renal Cell Carcinoma Management: From Molecular Mechanism to Clinical Practice. Front Oncol 2021; 11: 657639.
10. Whiting D and Sriprasad S. Molecular biology and targeted therapy in metastatic renal cell carcinoma. J Clin Urol 2020 Jan; 13(1): 40-49.
11. World Health Organization. Vietnam. Incidence, Mortality and Prevalence by cancer site. Source: Globocan 2020.
12. World Health Organization. World. Incidence, Mortality and Prevalence by cancer site. Source: Globocan 2020.


