HBsAg định lượng (qHBsAg) trong huyết thanh là một dấu ấn sinh học có giá trị thường được sử dụng cùng với tải lượng HBV DNA để phân loại bệnh nhân trong diễn biến tự nhiên của HBV, để theo dõi hiệu quả điều trị và đánh giá nguy cơ ung thư biểu mô tế bào gan (HCC).
TÓM TẮT
HBsAg định lượng (qHBsAg) trong huyết thanh là một dấu ấn sinh học có giá trị thường được sử dụng cùng với tải lượng HBV DNA để phân loại bệnh nhân trong diễn biến tự nhiên của HBV, để theo dõi hiệu quả điều trị và đánh giá nguy cơ ung thư biểu mô tế bào gan (HCC). Mức độ HBsAg thể hiện hoạt động sao chép của cccDNA nhưng không phản ánh số lượng tuyệt đối của cccDNA. Trong diễn biến tự nhiên của nhiễm HBV mạn, mức độ HBsAg cao nhất ở giai đoạn dung nạp miễn dịch, bắt đầu giảm ở giai đoạn thanh thải miễn dịch, rồi giảm từ từ ở giai đoạn chuyển đổi huyết thanh của HBeAg. Mức độ HBsAg thấp nhất ở những người mang virus ở trạng thái không hoạt động nhưng cao hơn ở những người HBeAg âm tính ở trạng thái tái hoạt động. Mức độ HBsAg ở bệnh nhân có HBeAg dương tính cao hơn ở bệnh nhân có HBeAg âm tính. Trong thực tế lâm sàng, HBsAg định lượng huyết thanh cần phải được sử dụng cùng với nhưng không thay thế được định lượng HBV DNA. Những bệnh nhân viêm gan B mạn HBeAg âm tính có mức độ HBsAg <1000 IU/mL và HBV DNA <2000 IU/mL được xác định là những người mang virus không hoạt động. Khi điều trị với peginterferon, mức độ HBsAg được sử dụng để xác định bệnh nhân sẽ không đáp ứng với điều trị ngay từ tuần thứ 12 để có thể chấm dứt điều trị hoặc thay đổi cách điều trị. Khi điều trị với các thuốc tương tự nucleos(t)ide (NA), sự giảm nhanh mức độ HBsAg trong thời gian điều trị cho thấy có khả năng để loại bỏ HBsAg trong tương lai. Mức độ HBsAg thấp <100 IU/mL có thể dự đoán nguy cơ tái phát thấp sau điều trị bằng thuốc uống NA. Ở bệnh nhân viêm gan B mạn HBeAg âm tính, sự kết hợp của mức độ HBsAg <1000 IU/mL và HBV DNA <2000 IU/mL có thể được xem như tiêu chuẩn xác định nguy cơ tối thiểu của ung thư biểu mô tế bào gan (HCC).
Quantitative HBsAg (qHBsAg): a valuable biomarker can be used to classify, monitor therapy and prognosis of patients with chronic hepatitis B
Luat NN
MEDLATEC General Hospital
ABSTRACT
Serum quantitative HBsAg (qHBsAg) is a valuable biomarker that can be used in association with HBV DNA to classify patients during the natural course of HBV, monitor therapy and predict risk for hepatocellular carcinoma (HCC). The HBsAg level is a reflection of the transcriptional activity of cccDNA but does not reflect the absolute number of cccDNA. During the natural course of chronic HBV infection, the level of HBsAg is highest in the immune tolerant phase, starts to decline during the immune clearance phase, and decrease slowly in HBeAg seroconversion phase. HBsAg level is lowest in inviduals with an inactive carriers state but higher in those who negative HBeAg with reactive state. HBsAg levels are higher in HBeAg-positive than in HBeAg-negative patients. In clinical practice, serum HBsAg level should be used together with, but not as a substitute for, HBV DNA. In HBeAg-negative chronic hepatitis B, an HBsAg level <1000 IU/mL and and HBV DNA level <2000 IU/mL accurately identify inactive carriers. During interferon (or peginterferon) treatment, HBsAg level is used identify patients who will not benefit from therapy as early as week 12 on therapy, so that treatment may be stopped or switched. During treatment with the nucleos(t)ide analogue (NA), the rapid HBsAg decrease during treatment suggests the body has the ability to clear HBsAg in the future. An HBsAg level of <100 IU/mL might predict lower risk of relapse after stopping NA treatment. In HBe Ag negative patients, the combination of HBsAg level < 1000 IU/mL and HBV DNA < 2000 IU/mL can be considered as a probable criteria to define the minimal risk for HCC.
Kể từ khi được phát hiện bởi Blumberg vào năm 1965, kháng nguyên bề mặt của virus viêm gan B HBsAg (Hepatitis B surface antigen) đã được sử dụng như một dấu ấn của sự nhiễm virus viêm gan B (HBV) [3]. Gần đây, xét nghiệm định lượng HBsAg trong huyết thanh (quantitative HBsAg: qHBsAg) không chỉ cho thấy rõ rệt hơn về diễn biến tự nhiên của nhiễm virus viêm gan B mà còn giúp dự đoán đáp ứng điều trị và tiên lượng của bệnh viêm gan B mạn.
1. Cấu trúc phân tử và sự tổng hợp HBsAg của HBV
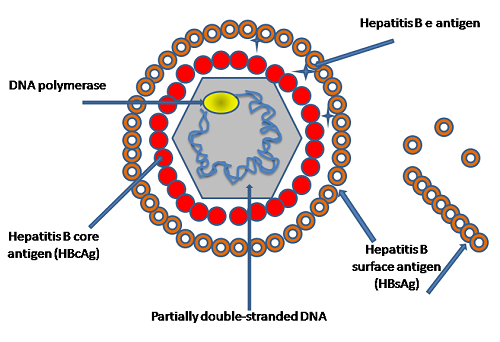
Với bộ gen chỉ gồm 3200 cặp base, HBV là virus loại DNA nhỏ nhất được biết đến cho đến nay. Khi xâm nhập vào cơ thể qua đường máu, HBV trú bỏ lớp vỏ protein, HBV DNA đi vào nhân tế bào gan người, tạo nên các DNA vòng gắn chặt đồng hóa trị được gọi là cccDNA (covalently closed circular DNA). Các cccDNA này gồm bốn đoạn khung đọc mở che phủ lẫn nhau ORFs (overlapping open reading frames): gen S mã hóa cho các protein bề mặt (surface), gen C mã hóa cho protein lõi (core), gen P mã hóa cho enzyme polymerase và gen X mã hóa cho protein X.
Cấu trúc phân tử của HBsAg gồm 3 loại protein là protein nhỏ (S), trung bình (M) và lớn (L), các protein này được sinh tổng hợp (dịch mã) từ các mRNA pre-S1 và mRNA S2/S sao chép từ gen S của cccDNA, theo 3 con đường: (1) Con đường HBsAg (HBsAg pathway): cccDNA sao chép ra các mRNA pre-S1 và S2/S, từ đó tổng hợp ra các HBsAg, các HBsAg được bài tiết từ tế bào gan vào máu dưới các dạng hình cầu (spheres) hoặc hình sợi mỏng (filaments), không có khả năng lây nhiễm vì không có thành phần DNA của virus. (2) Con đường sao chép ngoài nhiễm sắc thể (extra chromosomal pathway): mRNA được sao chép ngược lại thành HBV DNA nhờ emzyme sao chép ngược reverse transcriptase, HBsAg được sản xuất theo con đường (1) đến gắn vào và tạo thành các virion hoàn chỉnh, có khả năng lây nhiễm, ra khỏi tế bào gan, vào máu. (3) Con đường tích hợp (integration pathway): cccDNA cũng có khả năng tích hợp vào bộ gen của người, từ đó gen S sao chép ra các mRNA tương ứng và tổng hợp ra HBsAg để được bài tiết vào máu. Các hạt dưới virus (subviral) chứa các HBsAg nhưng không chứa DNA của HBV nên không có khả năng lây nhiễm nhưng được tạo thành ở mức độ cao gấp 100-100.000 lần so với mức độ tạo ra các virion hoàn chỉnh (Tseng TC và Kao JH 2013) [7].
Về mặt virus học, HBV DNA định lượng trong huyết thanh chỉ phản ánh hoạt động nhân lên của virus theo con đường sao chép ngược, còn HBsAg định lượng trong huyết thanh không chỉ được sản xuất do sự phiên dịch từ các mRNA của cccDNA hoạt động mà còn được sản xuất từ các đoạn HBV DNA đã được tích hợp vào bộ gen của người. Vì vậy, so với mức độ HBV DNA, mức độ HBsAg có thể cung cấp nhiều thông tin toàn diện hơn hơn về tình trạng nhiễm HBV của bệnh nhân (Tseng TC và Kao JH 2013) [7]. Cũng chính vì vậy, HBsAg định lượng trong huyết thanh là một dấu ấn sinh học có giá trị giúp theo dõi diễn biến, đáp ứng điều trị và tiên lượng viêm gan virus B mạn.
2. Chỉ định xét nghiệm HBsAg định lượng (qHBsAg):
Xét nghiệm qHBsAg (trong sự kết hợp với tải lượng HBV DNA) được chỉ định trong các trường hợp sau:
- Theo dõi quá trình diễn biến tự nhiên của nhiễm virus viêm gan B, đặc biệt là để chẩn đoán phân biệt giữa người mang virus không hoạt động (inactive cariers) với người viêm gan mạn có HBeAg âm tính.
- Theo dõi hiệu quả điều trị HBV bằng inteferon (IFN), peg-inteferon (PEG-IFN) hoặc bằng các thuốc uống tương tự nucleos(t)ide (NAs).
- Đánh giá nguy cơ xơ gan và ung thư biểu mô tế bào gan (HCC).
3. Những ứng dụng của HBsAg định lượng trong lâm sàng
Sự chuyển đổi huyết thanh (mất HBsAg và tạo nên HBsAb) hiếm khi được thấy trong tiến trình tự nhiên của sự nhiễm HBV mạn, thường chỉ chiếm khoảng 1-2% và đây cũng là cái đích tối ưu của điều trị. qHBsAg là một dấu ấn quan trọng để theo dõi diễn biến tự nhiên và dự đoán hiệu quả điều trị viêm gan B mạn.
3.1. Theo dõi diễn biến tự nhiên của nhiễm HBV
Trong quá trình diễn biến tự nhiên của nhiễm HBV, qHBsAg có thể được áp dụng một cách hiệu quả để phát hiện những người mang virus không hoạt động và để phát hiện những bệnh nhân cần điều trị ngay hoặc những bệnh nhân sẽ tái hoạt động trong tương lai gần. qHBsAg cũng có thể được áp dụng một cách phù hợp để phát hiện bệnh nhân chưa cần phải điều trị, bệnh nhân cần theo dõi chặt chẽ hơn và bệnh nhân cần phải điều trị (Bảng 1).
Bảng 1. Mức độ HBsAg và HBV DNA trong quá trình diễn biến tự nhiên của nhiễm virus viêm gan B.
| Các giai đoạn |
Dung nạp miễn dịch |
Thanh thải miễn dịch |
Mang virus không hoạt động |
HBeAg (-) tái hoạt động |
| Trạng thái HBeAg |
HBeAg (+)/ HBeAb (-) |
HBeAg (+)/ HBeAb (-) |
HBeAg (-)/ HBeAb (+) |
HBeAg (-)/ HBeAb (+) |
| Mức độ HBsAg (log10IU/mL) |
5,0 |
3,0-4,0 |
1,5-2,2 |
2,5-3,0 |
|
Mức độ HBV DNA (log10IU/mL)
|
7,5-8,5 |
6,0-7,0 |
1,0-2,4 |
3,9-4,6 |
| Tỷ lệ HBsAg/HBV DNA |
0,6-0,8 |
0,5-0,7 |
0,7 |
0,6-1,0 |
| |
|
|
|
|
Mức độ HBsAg và HBV DNA cũng được sử dụng để chẩn đoán phân biệt giữa người mang virus không hoạt động với người viêm gan B mạn có HBeAg (-) tính (Bảng 2).
Bảng 2. Giá trị cắt (cut-off) để phân biệt giữa người mang virus không hoạt động với bệnh HBeAg (-) tính tái hoạt động
| Các giá trị cắt |
|
| HBsAg < 1000 IU/mL và HBV DNA < 2000 IU/mL |
Có giá trị chẩn đoán người mang virus không hoạt động với độ nhạy = 91,1%, độ đặc hiệu = 95,4%, giá trị chẩn đoán (+) tính = 87,9%, giá trị chẩn đoán (-) tính = 96,7%. |
| HBsAg < 2000 IU/mL và HBV DNA < 2000 IU/mL |
Giá trị chẩn đoán (+) tính cho người mang virus không hoạt động = 93%. |
| HBsAg < 1000 IU/mL |
Giá trị chẩn đoán người mang virus không hoạt động với độ nhạy = 74,3%, độ đặc hiệu = 87,5%, giá trị chẩn đoán (+) tính = 89,7%. |
Theo Chan HL và cộng sự 2011 [1], qHBsAg là một dấu ấn sinh học để dự đoán và theo dõi đáp ứng điều trị viêm gan B mạn. Mức độ HBsAg huyết thanh ở bệnh nhân có HBeAg (+) tính có khuynh hướng cao hơn ở bệnh nhân có HBeAg (-) tính. Các bệnh nhân viêm gan B mạn với genotype D ở trạng thái HBeAg (-) tính có số lượng HBV DNA thấp (<2000 IU/mL), HBsAg < 1000 IU/mL và ỏ bệnh nhân nhiêm HBV genotype B hoặc C có HBsAg < 100 IU/mL được xác định là những người mang virus không hoạt động (inactive carriers). Theo Tseng TC và Kao JH 2013 [7], ở vùng Châu Á-Thái Bình dương, nơi các genotype B và C chiếm thế, các mức độ HBsAg ≤ 10-100 IU/mL dự đoán sự mất HBsAg theo thời gian.
3.2. Theo dõi hiệu quả điều trị
Trong quá trình điều trị, qHBsAg được sử dụng một cách hiệu quả để đánh giá đáp ứng điều trị HBV của các thuốc tiêm như Inteferon (IFN), peginteferon (PEG-IFN) hoặc của các thuốc uống tương tự nucleos(t)ide (NA). qHBsAg cũng có thể được áp dụng để phát hiện các bệnh nhân cần tiếp tục điều trị, các bệnh nhân có triển vọng thải sạch HBsAg và các bệnh nhân ít có khả năng tái phát để dừng hoặc thay thế phác đồ điều trị.
3.2.1.Đánh giá đáp ứng điều trị HBV của IFN hoặc PEG-IFN.
Ở những bệnh nhân có HBeAg (+) tính: các nghiên cứu gần đây chỉ ra rằng qHBsAg có thể giúp chỉ ra các bệnh nhân có đáp ứng bền vững (sustained viral response: SVR) hoặc không đáp ứng (non-responder) đối với điều trị các thuốc tiêm IFN hoặc PEG-IFN. Theo Chan HL và cộng sự 2010 [2], ở tuần thứ 24 của quá trình điều trị, tỷ lệ đáp ứng bền vững (SVR) ở các bệnh nhân có HBsAg ≤ 300 IU/mL là 62% và ở các bệnh nhân có HBsAg ≥ 300 IU/mL là 11%. Các tác giả cũng chỉ ra rằng sự đáp ứng kết hợp của cả HBsAg ≤ 300 IU/mL và có tốc độ giảm HBsAg ≥ 1 log10 IU/mL ở tuần thứ 24 có một tỷ lệ đáp ứng bền vững (SVR) cao hơn nếu không có sự đáp ứng kết hợp (tương ứng với 75% so với 15%), tương ứng với giá trị chẩn đoán (+) tính (PPV) và (-) tính là 75% và 85%. Ở thời điểm kết thúc điều trị, các mức độ cơ bản của HBsAg ở những bệnh nhân có chuyển đổi huyết thanh của HBeAg thường là thấp hơn ở những bệnh nhân không chưa có chuyển đổi huyết thanh.
Ở những bệnh nhân có HBeAg (-) tính: tỷ lệ đáp ứng đối với điều trị bằng PEG-IFN ở những bệnh nhân có HBeAg (-) tính thường là thấp hơn (<20%) so với những bệnh nhân có HBeAg (+) tính. Các bệnh nhân này rất khó theo dõi hiệu quả điều trị. Các nghiên cứu gần đây gợi ý rằng qHBsAg là một dấu ấn đáng quan tâm (worthwhile marker) đối với việc theo dõi điều trị HBV bằng PEG-IFN. Theo Rijckborst V và cộng sự 2010 [5], sự kết hợp giữa sự giảm cả HBsAg và tải lượng HBV DNA là chỉ dẫn tốt nhất cho một đáp ứng bền vững (SVR) ở bệnh nhân được điều trị với PEG-IFN.
Quy tắc dừng điều trị tuần thứ 12 (week 12 stopping rule): cũng theo Rijckborst V và cộng sự 2012 [6], giá trị chẩn đoán âm tính (NPV) là ≥ 95% khi không có sự giảm HBsAg hoặc một sự giảm HBV DNA < 2 log10 IU/mL ở tuần thứ 12 của điều trị PEG-IFN. Từ đó, các nhà khoa học đã đánh giá động học của HBsAg và đưa ra quy tắc dừng điều trị ở tuần thứ 12. Việc phát hiện sớm sự không đáp ứng đối với điều trị (non-responder) ở tuần thứ 12 giúp người thầy thuốc kịp thời dừng điều trị để thay bằng một phác đồ điều trị mới.
3.2.2.Đánh giá đáp ứng điều trị HBV của các thuốc uống NA.
Các thuốc chống HBV dạng uống loại tương tự nucleos(t))id (NA) có tác dụng ức chế sự nhân lên của HBV bằng cách ức chế quá trình sao chép ngược (reverse transcription) của virus. Theo Reijnder JG và cộng sự 2011 [4], trong quá trình điều trị HBV với các thuốc uống (NA), mặc dù tải lượng HBV DNA nhanh chóng giảm xuống có thể đến mức không thể phát hiện được, nhưng mức độ giảm của HBsAg không nhanh bằng khi điều trị với các thuốc tiêm IFN hoặc PEG-IFN. Zoutendijk và cộng sự 2010 [10] khi nghiên cứu động học của HBsAg ở các bệnh nhân được điều trị lâu dài với entecavir (ETV) và tenofovir (TDF) đã thấy rằng thời gian trung bình để làm qHBsAg giảm 1 log10 IU/mL ở bệnh nhân có HBeAg (+) tính là 6,6 năm và ở bệnh nhân có HBeAg (-) tính là 8 năm; thời gian trung bình để làm sạch qHBsAg trong huyết thanh ở bệnh nhân có HBeAg (+) tính là 36 năm và ở bệnh nhân có HBeAg (-) tính là 39 năm. Các kết quả này cho thấy tầm quan trọng của việc xác định điểm cắt (cut-off) của HBsAg để dừng điều trị bằng các thuốc uống với nguy cơ tái phát thấp nhất. Về tốc độ giảm HBsAg trong quá trình điều trị, theo Wurshorn K và cộng sự 2010 [9], ở những bệnh nhân có HBeAg (+) tính và HBV DNA < 60 IU/mL, sau 3 năm điều trị với telbivudine, số bệnh nhân có sự giảm qHBsAg ≥ 1 log10 IU/mL sau một năm điều trị có tỷ lệ mất qHBsAg là 25%, trong khi số bệnh nhân có sự giảm qHBsAg < 1 log10 IU/mL chỉ có tỷ lệ mất qHBsAg chỉ là 1,4%. Ở các bệnh nhân có HBeAg (-) tính, không thấy có sự giảm mức độ qHBsAg được điều trị bằng entecavir (ETV). Ở các bệnh nhân được điều trị bằng các thuốc uống NA, mức độ qHBsAg cơ bản thấp và sự giảm sớm của HBsAg ở tuần thứ 24 của điều trị là yếu tố dự đoán tốt cho sự đáp ứng bền vững. Một điểm cắt (cut-off) ≤ 2-3 log10 IU/mL của qHBsAg có thể được sử dụng để tạm dừng điều trị (discontinuation). Mức độ qHBsAg khi kết thúc điều trị càng cao, nguy cơ tái phát (relaps) càng cao: nếu mức độ qHBsAg ≤ 3 log10 IU/mL thì nguy cơ tái phát là 31%, nếu mức độ qHBsAg ≤ 2 log10 IU/mL thì nguy cơ tái phát chỉ còn là 9%. Theo Tseng TC và Kao JH 2013 [7], sự giảm nhanh HBsAg trong quá trình điều trị với các thuốc uống (NA) chứng tỏ bệnh nhân có triển vọng thải sạch HBsAg trong tương lai. Việc định lượng qHBsAg và tải lượng HBV DNA khoảng 6 tháng đến 12 tháng một lần sẽ giúp tối ưu hóa việc quản lý bệnh nhân viêm gan B mạn trong thực tế lâm sàng.
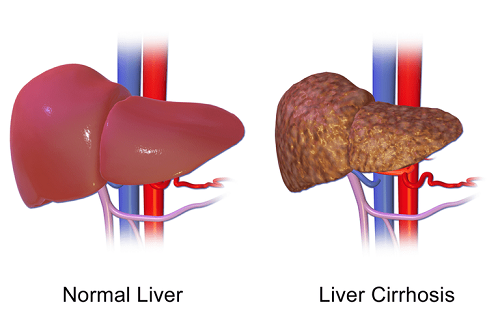
3.3. Đánh giá tiên lượng xơ gan và ung thư biểu mô tế bào gan (HCC)
Theo Tseng TC 2012 [8], Tseng TC và Kao JH 2013 [7], những bệnh nhân có HBeAg (-) tính với tải lượng HBV DNA máu thấp < 2000 IU/mL (<104 copies/mL) nhưng mức độ qHBsAg cao > 1000 IU/mL thì nguy cơ xơ gan và ung thư biểu mô tế bào gan (HCC) cao hơn ở những người có mức độ qHBsAg < 1000 IU/mL. Ở bệnh nhân HBeAg (-) tính, sự kết hợp giữa mức độ HBsAg < 1000 IU/mL và tải lượng HBV DNA thấp < 2000 IU/mL (<104 copies/mL) có thể được xem như các giá trị cắt của nguy cơ tối thiểu đối với ung thư biểu mô tế bào gan (HCC).
Tài liệu tham khảo
- Chan HL, Thompson A, Martinot-Peignoux M, et al. Hepatitis B surface antigen quantification: why and how to use it in 2011 - a core group report. J Hepatol 2011 Nov; 55(5): 1121-1131.
- Chan HL, Wong VW, Chim AM, et al. Serum HBsAg quantification to predict response to peginterferon therapy of e antigen positive chronic hepatitis B. Aliment Pharmacol Ther 2010 Dec; 32(11-12): 1323-1331.
- Martinot-Peignoux M, Lapalus M, Asselah T, Marcellin P. The role of HBsAg quantification for monitoring natural history and treatment outcome. Liver Int 2013 Feb; 33 Suppl 1: 125-132.
- Reijnders JG, Rijckborst V, Sonneveld MJ, et al. Kinetics of hepatitis B surface antigen differ between treatment with peginterferon and entecavir. J Hematol 2011 Mar; 54(3): 449-454.
- Rijckborst V, Hansen BE, Cakaloglu Y, et al. Early on-treatment prediction of response to peginterferon alfa-2a for HBeAg-negative chronic hepatitis B using HBsAg and HBV DNA levels. Hematology 2010 Aug; 52(2): 454-461.
- Rijckborst V, Hansen BE, Ferenci P, et al. Validation of a stopping rule at week 12 using HBsAg and HBV DNA for HBeAg-negative patients treated with peginterferon alfa-2a. J Hematol 2012 May; 56(5): 1006-1011.
- Tseng TC, Kao JH. Clinical utility of quantitative HBsAg in natural history and nucleos(t)ide analogue treatment of chronic hepatitis B: new trick of old dog. J Gastroenterol 2013 Jan; 48(1): 13-21.
- Tseng TC, Liu CJ, Yang HC, et al. High levels of hepatitis B surface antigen increase risk of hepatocellular carcinoma in patients with low HBV load. Gastroenterology 2012 May; 142(5): 1140-1149.
- Wursthorn K, Jung M, Riva A, et al. Kinetics of hepatitis B surface antigen decline during 3 years of telbivudine treatment in hepatitis B e antigen-positive patients. Hematology 2010 Nov; 52(5): 1611-1620.
- Zoutendijk R, Hansen BE, Van Vuuuren Ạ, et al. Prediction Of HBsAg Loss Using HBsAg Decline After Long-Term Virological Response To Nucleos(t)ide Analogue Therapy For Chronic Hepatitis B. Hematology 2010; (Suppl): 509A.
* Hiện nay, xét nghiệm HBsAg định lượng đang được thực hiện hàng ngày tại Bệnh viện Đa khoa MEDLATEC bằng phương pháp miễn dịch điện hóa phát quang (electrochemiluminescence immunoassay ECLIA) trên máy Elecsys Cobas e (Roche), góp phần quyết định vào việc phân loại giai đoan bệnh, theo dõi hiệu quả điều trị và tiên lượng bệnh nhân nhiễm HBV mạn.


