Viêm gan B nếu không được phát hiện và điều trị kịp thời sẽ gây ra nhiều biến chứng nguy hiểm. Do đó, việc cập nhật về các dấu ấn sinh học sử dụng để sàng lọc, chẩn đoán và theo dõi nhiễm virus viêm gan B là điều cần thiết.
Tóm tắt
1) Các dấu ấn sinh học sử dụng để sàng lọc, chẩn đoán và theo dõi nhiễm HBV gồm các dấu ấn hóa sinh (ALT, AST, AFP, AFP-L3, DCP, albumin, bilirrubin, …), miễn dịch (HBeAg, HBeA, qHBsAg), sinh học phân tử (HBV DNA, các đột biến DNA gây xơ gan và ung thư biểu mô tế bào gan, các đột biến kháng thuốc) và huyết học (tiểu cầu, đông máu).
2) Các dấu ấn sinh học sử dụng để sàng lọc và chẩn đoán nhiễm HBV cấp gồm: HBsAg (+) tính, HBcAb (+) tính và HBcAb IgM (+) tính.
3) Các dấu ấn sinh học sử dụng để chẩn đoán và theo dõi nhiễm HBV mạn gồm: HBsAg (+) tính trên 6 tháng. Các xét nghiệm để đánh giá các giai đoạn nhiễm HBV mạn gồm sự thay đổi của các dấu ấn sinh học: ALT, số lượng virus HBV DNA, HBeAg, HBeAb, qHBsAg. Các xét nghiệm đánh giá nguy cơ xơ gan và HCC gồm các đột biến trên vùng BCP/PC của gen C (basal core promotor/ precore) và đánh giá sự kháng thuốc gồm các đột biến trên gen P (polymerase).
4) Các dấu ấn sinh học sử dụng để sàng lọc và chẩn đoán viêm gan virus B thể tiềm ẩn (OBI) được dựa trên 3 thông số: HBsAg âm tính, HBcAb dương tính và sự hiện diện của HBV DNA mức độ thấp trong huyết thanh (<200 IU/mL) hoặc trong mô gan.
5) Các dấu ấn sinh học sử dụng để đánh giá mức độ xơ hóa gan hoặc xơ gan do viêm gan virus B gồm: AST/ ALT tăng, APRI (AST và tiểu cầu) tăng, FIB-4 (Tuổi, AST, ALT và tiểu cầu) tăng, hoặc số lượng tiểu cầu giảm.
6) Các dấu ấn sinh học sử dụng để phát hiện sớm ung thư biểu mô tế bào gan (HCC) gồm: AFP, AFP-L3 và DCP. Mặc dù AFP đã được sử dụng đã được sử dụng từ lâu nhưng chưa bao giờ được FDA phê chuẩn như một dấu ấn một mình để phát hiện HCC. Sự kết hợp giữa AFP, AFP-L3 và DCP, tính theo GALAD score (Wako i30) có thể cải thiện độ chính xác để phát hiện sớm HCC, ngay cả khi khối u ở giai đoạn I, với chỉ khối u và kích thước khối u <2 cm.
Update on biomarkers for screening, diagnosis and monitoring of hepatitis B infection
Luat Nghiem Nguyen
MEDLATEC General Hospital
Abstract
1) Biomarkers for the screening, diagnosis and monitoring of HBV infection include the biochemical (ALT, AST, AFP, AFP-L3, DCP, albumin, bilirubin, …), immunological (HBeAg, HBeA, qHBsAg), molecular (HBV DNA, mutations for cirrhosis and hepatocellular carcinoma, resistance mutations) and hematological biomarkers (platelets, coagulation, …).
2) Biomarkers for the screening and diagnose of acute HBV infection include: HBsAg positive, HBcAb positive and HBcAb IgM positive.
3) Biomarkers for the diagnose and monitoring of chronic HBV infection include: HBsAg positive over 6 months. Tests for assessing stages of chronic HBV infection include: ALT, HBV DNA, HBeAg, HBeAb, qHBsAg. Tests for risk of cirrhosis and HCC in chronic hepatitis B include: mutations in the BCP / PC region of C gene, and for resistance to mutations in P. gene.
4) Biomarkers for the screening and diagnosis of occult hepatitis B infection (OBI) was based on three parameters: serum negative HBsAg, positive HBcAb and serum HBV DNA levels (<200 IU/mL) or HBV DNA in liver tissue.
5) Biomarkers for the assess of liver fibrosis or cirrhosis due to hepatitis B include: AST/ ALT, APRI (AST and platelets), FIB-4 (age, AST, ALT and platelets), and platelets.
6) Biomarkers for early detection of hepatocellular carcinoma (HCC) include: AFP, AFP-L3 and DCP. Although AFP has been used for a long time, it has never been approved by FDA as a single mark to detect HCC. The combination of AFP, AFP-L3 and DCP, calculated according to GALAD score (Wako i30) can improve accuracy for early detection of HCC, even if the tumor is in stage I, with only one tumor and the tumor size <2 cm.
*
Theo Tổ chức Y tế Thế giới (WHO) 2015 [9], trên thế giới hiện có khoảng 240 triệu người đang bị nhiễm HBV mạn, nghĩa là có kháng nguyên bề mặt viêm gan B (HBsAg) dương tính trên 6 tháng. Mỗi năm trên thế giới có khoảng hơn 650.000 người tử vong do các biến chứng của viêm gan B mạn, chủ yếu do xơ gan và ung thư biểu mô tế bào gan. Ở Việt Nam, năm 2013 có khoảng 8,6 triệu người bị nhiễm HBV mạn.
Virus viêm gan B có khả năng tồn tại bên ngoài cơ thể ít nhất là 7 ngày. Thời kỳ ủ bệnh của virus viêm gan B trung bình là 75 ngày, nhưng có thể thay đổi từ 30 đến 180 ngày. Virus viêm gan B có thể lây từ mẹ sang con khi sinh, cũng có thể lây lan qua da hoặc niêm mạc.
Khả năng nhiễm virus trở thành mạn tính phụ thuộc vào độ tuổi người bị nhiễm bệnh. Trẻ em dưới 6 tuổi bị nhiễm virus viêm gan B thì hầu hết bị phát triển bệnh nhiễm HBV mạn tính. Ở trẻ em, 30-50% trẻ em bị nhiễm trước khi 6 tuổi bị nhiễm trùng mạn tính. Ở người lớn: <5% số người nhiễm HBV có thể trở thành viêm gan B mạn, 20-30% có thể bị tiến triển thành xơ gan hoặc ung thư gan.
Các dấu ấn sinh học được sử dụng để sàng lọc, chẩn đoán và theo dõi nhiễm HBV gồm các dấu ấn về Hóa sinh (ALT, AST, AFP, AFP-L3, DCP, albumin, bilirrubin, …), Miễn dịch (HBeAg, HBeA, qHBsAg), Sinh học phân tử (HBV DNA, đột biến DNA gây xơ gan và ung thư biểu mô tế bào gan, đột biến kháng thuốc) và huyết học (tiểu cầu, đông máu).
1. Các dấu ấn sinh học sử dụng để sàng lọc và chẩn đoán nhiễm HBV cấp
Nhiễm HBV cấp được đặc trưng bởi sự hiện diện của HBsAg và kháng thể HBcAb IgM (+) tính. Trong giai đoạn đầu của bệnh, bệnh nhân cũng (+) tính với kháng nguyên e (HBeAg). HBeAg thường là một dấu hiệu của sự nhân lên của virus. Sự hiện diện của HBeAg chỉ ra rằng máu và chất dịch cơ thể của người bị nhiễm bệnh là rất dễ lây. Các kết quả sàng lọc bằng Miễn dịch của một người đến khám được thể hiện ở Bảng 1.
Bảng 1. Giải thích các kết quả xét nghiệm Miễn dịch trong sàng lọc nhiễm HBV (Hadziyannis E và Laras A, 2018 [2])
|
HBsAg
|
HBcAb
|
HBcAb-IgM
|
HBsAb
|
Giải thích
|
|
-
|
-
|
-
|
-
|
Không bị nhiễm HBV, dễ bị nhiễm
|
|
-
|
+
|
-
|
+
|
Đã miễn dịch do nhiễm HBV trước đây
|
|
-
|
-
|
-
|
+
|
Đã miễn dịch do tiêm vaccin viêm gan B
|
|
+
|
+
|
+
|
-
|
Viêm gan B cấp
|
|
+
|
+
|
-
|
-
|
Viêm gan B mạn
|
|
-
|
+
|
-
|
-
|
Không xác định, có thể do:
1) Đã nhiễm trước đây (phổ biến nhất)
2) HBcAb (+) tính giả
3) Viêm gan B thể tiềm ẩn (OBI)
|
2. Các dấu ấn sinh học sử dụng để chẩn đoán các giai đoạn trong nhiễm HBV mạn
Nhiễm HBV mạn tính được đặc trưng bởi sự tồn tại của HBsAg trong ít nhất 6 tháng (có hoặc không có đồng thời HBeAg).
Viêm gan B mạn được chia thành 4 giai đoạn (phases). Các xét nghiệm để đánh giá các giai đoạn của nhiễm HBV mạn tính gồm các xét nghiệm về Hóa sinh (ALT), Miễn dịch (HbeAg, HBeA, qHBsAg) và Sinh học phân tử (số lượng virus: HBV DNA) (Alavial SM, et al, 2016 [1]).
1) Giai đoạn dung nạp miễn dịch (immune tolerance): ALT bình thường, HBV DNA cao, HBeAg (+) tính, HBeAb (-) tính và HBsAg định lượng cao, thường chưa cần điều trị nhưng phải theo dõi.
2) Giai đoạn hoạt động miễn dịch hay thanh thải miễn dịch (Immune active or Immune clearance): ALT cao, HBV DNA cao, HBeAg (+) tính, HBeAb (-) tính và HBsAg định lượng cao, cần điều trị.
3) Giai đoạn kiểm soát miễn dịch hay người mang virus không hoạt động (immune control or inactive carier): ALT bình thường, HBV DNA thấp < 104 copies/ mL, HBeAg (-) tính, HbeAb (+) tính và HBsAg định lượng < 100 IU/ mLđối với genotype B và < 50 IU/ mL đối với gentype C, thường không cần điều trị nhưng phải theo dõi tái phát hoặc HCC.
Theo Luật NN và cs, 2015 [5], khi sử dụng qHBsAg (HBsAG định lượng) để đánh giá, tỷ lệ người mang virus không hoạt động thật (qHBsAg <100 ng/mL) trong số những người viêm gan B mạn chưa điều trị được xem là mang HBV không hoạt động chỉ là 30,10%. Tỷ lệ người mang HBV không hoạt động thật trong số những người viêm gan B mạn được điều trị NAs 48 tuần được xem là mang HBV không hoạt động chỉ là 26,73%.
4) Giai đoạn tái phát hay giai đoạn cấp của viêm gan B mạn (Reactivation or acute on chronic hepatitis): ALT cao, HBV DNA cao, HBeAg (-) tính có thể chuyển đổi thành (+) tính, HBeAb (+) tính và HBsAg định lượng cao, nguy cơ xơ gan mất bù cao, cần điều trị.
Những thay đổi về Hóa sinh (ALT), Miễn dịch (HBeAg và HbeA) và Sinh học phân tử (HBV DNA) và Mô bệnh học ở 4 giai đoạn viêm gan B mạn được thể hiện ở Bảng 2.
Bảng 2. Những thay đổi về Hóa sinh (ALT), Miễn dịch (HBeAg và HbeA), Sinh học phân tử (HBV DNA) và Mô bệnh học trong quá trình viêm gan B mạn
|
Giai đoạn
|
ALT
|
HBV DNA*
|
HBeAg
|
Mô bệnh học gan
|
|
Dung nạp miễn dịch
|
Bình thường
|
>1 triệu IU/mL
|
+
|
Viêm và xơ hóa tối thiểu
|
|
Hoạt động miễn dịch
|
Tăng
|
≥20.000 IU/mL
|
+
|
Viêm và xơ hóa vừa đến nặng
|
|
Virus không hoạt động
|
Bình thường
|
<2000 IU/mL
|
-
|
Viêm hoại tử tối thiểu nhưng xơ hóa khác nhau
|
|
Tái phát
|
Tăng
|
≥20.000 IU/mL
|
-
|
Viêm vừa đến nặng hoặc xơ hóa gan
|
*Ghi chú: 1 IU/mL = 5,6 copies/mL; gần đây, nhiễm HBV mạn không hoạt động “thật” còn thêm tiêu chuẩn qHBsAg <100 ng/mL.
Các xét nghiệm sử dụng để đưa ra quyết định điều trị, theo dõi hiệu quả điều trị theo Chiến lược điều trị theo Tổ chức Y tế Thế giới 2015 [9] gồm:
- Khi nào chưa điều trị nhưng cần tiếp tục theo dõi?
Đó là khi chưa có bằng chứng xơ gan APRI score ≤ 2 hay FibroScan, ALT bình thường, mức độ HBV DNA ≤ 10^5 copies/ mL ở bệnh nhân có HBeAg (+) tính hoặc ≤ 10^4 copies/ mL, ở bệnh nhân có HBeAg (-) tính và tuổi ≤ 30. Những người này cần được theo dõi về HBV DNA và ALT 6 – 12 tháng một lần.
- Khi nào bắt đầu điều trị?
Khi viêm gan B mạn có bằng chứng của xơ gan còn bù hoặc mất bù (hoặc APRI score >2 hay FibroScan > F4 ở người lớn) sẽ được điều trị, bất kể mức độ ALT, trạng thái HBeAg hoặc mức độ HBV DNA thế nào. Việc điều trị cũng được bắt đầu ở những người lớn bị viêm gan B mạn không có bằng chứng của xơ gan (hoặc APRI score ≤ 2 hay FibroScan < F4) nhưng tuổi > 30, có mức độ HBV DNA ≥ 10^5 copies/ mL ở bệnh nhân có HBeAg (+) tính hoặc ≥ 10^4copies/ mL ở bệnh nhân có HBeAg (-) tính và có ALT tăng > 2 lần giới hạn trên; nếu tăng ≤ 2 lần giới hạn trên thì theo dõi 3 tháng một lần, nhưng nếu >30 tuổi thì cũng cần điều trị với ETV, TDF hoặc PegIFN-α. Ở những bệnh nhân đồng nhiễm HBV/HIV, ART (antiretroviral therapy) sẽ được bắt đầu điều trị nếu có bằng chứng của bệnh gan mạn nặng, bất kể số lượng nào của CD4 và ở tất cả các bệnh nhân có số lượng CD4 ≤ 500 tế bào/ mm3bất kể giai đoạn nào của bệnh gan.
- Khi nào dừng điều trị?
Đó là khi HBV DNA giảm xuống dưới ngưỡng phát hiện, lúc này cần tiếp tục điều trị từ 6 tháng đến 1 năm để giảm nguy cơ tái phát. Ba tháng cần xét nghiệm lại một lần, nếu cả 3 lần HBV DNA (-) tính, ALT bình thường, HBeAg (-) tính và qHBsAg <100 IU/mL đối với genotype B và <50 IU/mL đối với genotype C, tốt nhất là qHBsAg (-) tính, thì có thể tạm dừng thuốc. Tiếp tục theo dõi HBV DNA 6 tháng một lần.
Đối với các đột biến của HBV liên quan đến xơ gan, theo Luật NN và cs, 2013 [3], ở bệnh nhân nhiễm HBV mạn ở miền Bắc Việt Nam, có 7 đột biến vùng BCP/PC của HBV liên quan với xơ gan được phát hiện ở các nu 1726, 1727, 1730, 1766, 1768, 1773 và 1799, chiếm 31,94%.
Đối với các đột biến của HBV liên quan đến HCC, theo Luật NN và cs, 2013 [3], có 6 đột biến vùng BCP/PC liên quan với HCC được phát hiện gồm T1753V (C/A/G/xóa), A1762T/G1764A, A1846T, G1896A và G1899A, chiếm 13,89%; trong đó, số bệnh nhân vừa có đột biến liên quan với xơ gan, vừa có đột biến liên quan với HCC chiếm 37,50%; số bệnh nhân có từ 1 đến 6 đột biến liên quan với HCC chiếm 51,49%, trong đó đột biến kép A1762T/ G1764A chiếm 30,56%. Tỷ lệ các đột biến đơn tại vùng BCP/PC của HBV có liên quan một cách có ý nghĩa đối với HCC khác nhau giữa genotype B và genotype C (Bảng 3).
Bảng 3. Tần suất các đột biến đơn và kép vùng BCP/PC có liên quan đến nguy cơ ung thư tế bào gan ở genotype B và genotype C (Luật NN và cs, 2013 [3])
|
Các đột biến
|
Genotype B (%)
|
Genotype C (%)
|
|
T1753V/C/G/A/xóa*
|
8 (50,00)
|
8 (50,00)
|
|
A1762T
|
14 (51,85)
|
13 (48,15)
|
|
G1764A
|
9 (39,13)
|
14 (60,87)
|
|
A1846T
|
7 (70,00)
|
3 (30,00)
|
|
G1896A
|
17 (87,27)
|
5 (22,73)
|
|
G1899A
|
3 (50,00)
|
3 (50,00)
|
|
A1762T/G1764A
|
9 (40,91)
|
13 (59,09)
|
|
A1762T/G1764A + T1753V
|
2 (20,00)
|
8 (80,00)
|
*Ở đột biến T1753V, V có thể là C, G, A hoặc bị xóa, trong đó số thay thế T bằng C là 8/16 (50,00%), G là 4/16 (25,00%), A là 3/16 (18,75%) và T bị xóa là 1/16 (6,25%).
Đối với các đột biến của HBV liên quan đến kháng thuốc, theo Luật NN và cs, 2014 [4], ở khu vực Miền Bắc Việt Nam, tỷ lệ bệnh nhân nhiễm HBV có các đột biến kháng thuốc là 41,41%. Trong số các đột biến kháng thuốc của HBV được phát hiện, có 5 loại đột biến đơn là M204I (1,52%), A181T (0,5%), S85I/F/A (3,5%), L80I (0,5%) và V207M/L (31,31%), có khả năng kháng với các thuốc chống HBV như Lamivudine, Adefovir, Entecavir, Telbivudine và Emtricitabine, trong số đó chỉ có 0,5% số bệnh nhân có đa đột biến; chưa phát hiện được đột biến nào có liên quan đến kháng Tenofovir (Bảng 4).
Bảng 4. Các đột biến kháng thuốc của HBV ở miền Bắc Việt Nam (Luật NN và cs, 2014 [4])
|
Thứ tự
|
Các đột biến kháng thuốc của HBV
|
Tỷ lệ (%)
|
|
1
|
M204I
|
1,52
|
|
2
|
A181T
|
0,50
|
|
3
|
S85I/F/A
|
3,50
|
|
4
|
L80I
|
0,50
|
|
5
|
V207M/L
|
31,31
|
3. Các xét nghiệm để chẩn đoán viêm gan virus B thể tiềm ẩn
Các xét nghiệm để chẩn đoán viêm gan virus B thể tiềm ẩn (Occult Hepatitis B Infection: OBI) gồm: HBsAg âm tính, HBcAb dương tính và sự hiện diện của HBV DNA mức độ thấp trong huyết thanh (<200 IU/mL) hoặc trong mô gan. Nguyên nhân gây nên dạng tiềm ẩn có thể do một số yếu tố của vật chủ hoặc một số đột biến ở các vùng preS1, preS2 và S của gen S của HBV, làm HBV không tổng hợp được HBsAg, nên không thể phát hiện được.
Tỷ lệ nhiễm virus viêm gan B tiềm ẩn được báo cáo là từ 0,1% đến 6% trên toàn thế giới.
Nhiễm HBV tiềm ẩn (với <200 IU/mL) có thể được chia thành 2 nhóm dựa trên các kháng thể của HBV: nhóm OBI dương tính (HBcAb dương tính và/ hoặc HBsAg dương tính) và nhóm OBI âm tính (HBcAb âm tính và HBsAb âm tính), chiếm khoảng 20%. Nhóm OBI âm tính có thể do có các đột biến hoặc do sự mất dần của HBsAb.
Tiêu chuẩn vàng cho chẩn đoán OBI là có HBV DNA trong dịch chiết DNA từ gan, bởi vì cccDNA vẫn tồn tại dai dẳng trong các tế bào gan và ngay cả khi HBV DNA không xuất hiện trong huyết thanh. Ngày nay, kỹ thuật real-time PCR định lượng HBV DNA huyết thanh với độ nhạy cao (real-time PCR với COBAS Tagman có độ nhạy <5 IU/mL) đã được sử dụng một cách rộng rãi để chẩn đoán OBI.
4. Các xét nghiệm sử dụng trong đánh giá mức độ xơ hóa gan hoặc xơ gan
Các xét nghiệm sử dụng để đánh giá mức độ xơ hóa gan hoặc xơ gan có nhiều, nhưng các chỉ số tỷ lệ AST/ALT, APRI, FIB-4 và tiểu cầu, tính toán dễ dàng, thường được sử dụng như bước đầu tiên để loại trừ các bệnh nhân không bị xơ hóa gan tiến triển, đã thật sự ngăn cản việc sinh thiết gan không cần thiết ở phần lớn bệnh nhân.
Các chỉ số APRI và FIB-4 có thể xác nhận sự xơ hóa gan có liên quan đến viêm gan B mạn với độ nhạy và độ đặc hiệu ở mức độ trung bình; tuy nhiên, cả hai chỉ số này không phù hợp để đánh giá sự cải thiện về mức độ xơ hóa gan sau điều trị kháng virus B. Khi nghi ngờ xơ hóa gan hoặc xơ gan, có thể kết hợp với siêu âm hoặc sinh thiết để chẩn đoán. Giá trị của các xét nghiệm trong đánh giá mức độ xơ gan ở bệnh nhân viêm gan B mạn được thể hiện ở Bảng 5.
Bảng 5. Giá trị của các xét nghiệm trong đánh giá mức độ xơ gan ở bệnh nhân viêm gan B mạn.(Wang HW et al, 2017 [9])
|
TT
|
Các thông số
|
Giá trị cắt
|
Độ nhạy (%)
|
Độ đặc hiệu (%)
|
PPV (%)
|
NPV (%)
|
|
1
|
AAR
|
0,8
|
77,5
|
66,6
|
43,8
|
89,8
|
|
2
|
APRI
|
0,7
|
74,3
|
48,4
|
32,6
|
84,9
|
|
3
|
FIB-4
|
2,2
|
72,7
|
75,7
|
50,1
|
89,2
|
|
4
|
Tiểu cầu
|
140
|
65,5
|
82,9
|
56,2
|
87,8
|
5. Các xét nghiệm phát hiện sớm ung thư biểu mô tế bào gan
Mặc dù AFP (alpha-fetoprotein) đã được được sử dụng kết hợp với siêu âm để chẩn đoán HCC từ lâu nhưng nó chưa bao giờ được FDA (Food and Drug Administration) phê chuẩn như là một dấu ấn khối u sử dụng một mình để chẩn đoán HCC vì nó không đủ độ nhạy và độ đặc hiệu. Gần đây, 2 dấu ấn khối u mới đã được FDA xác nhận để chẩn đoán HCC là AFP-L3 và DCP. Tuy nhiên, cả hai dấu ấn không u này cũng không thể sử dụng riêng lẻ để chẩn đoán sớm HCC.
AFP-L3, một đồng dạng fucosyl hóa của AFP, gắn với lectin Lens culinarisagglutinin, đặc hiệu hơn cho HCC, thường tăng ở bệnh nhân HCC. Tỷ lệ AFP-L3/ AFP toàn phần ≥10% là nguy cơ tăng của sự tiến triển HCC.
DCP (des-gamma-carboxy prothrombin) hay còn gọi là PIVKA-II (protein induced by vitamin K absence hoặc antagonist-II), là một protein prothrombin của prothrombin. Các tế bào HCC có bất thường về carboxyl hóa, tạo nên tiền chất prothrombin chưa được carboxyl hóa (DCP), thể hiện sự hoạt động của HCC, đóng vai trò là dấu ấn khối u của HCC.
Gần đây, mô hình GALAD score, được tính từ tuổi, giới, AFP, AFP-L3 và DCP, trên máy của Wako i30 (Nhật Bản), có thể giúp tính toán xác suất HCC ở một bệnh nhân tốt hơn bất kỳ một dấu ấn khối u sử dụng một mình nào (Roberts LR, et al, 2016 [7]).
Về tỷ lệ dương tính của các dấu ấn khối u này trong chẩn đoán sớm HCC, trong một nghiên cứu về các dấu ấn khối u AFP-AFP-L3 và DCP ở 685 bệnh nhân HCC, sử dụng các điểm cắt (cut-off) của AFP = 20 ng/dL, AFP-L3 = 10% và DCP =40 mAU/mL (0,48 ng/mL), Toyoda H, et al, 2006 [8], thấy có sự khác nhau về tỷ lệ tăng (dương tính) của từng dấu ấn khối u, của 2 hoặc cả 3 dấu ấn, hoặc cả 3 dấu ấn đều không tăng, ở bệnh nhân HCC (Hình 1).
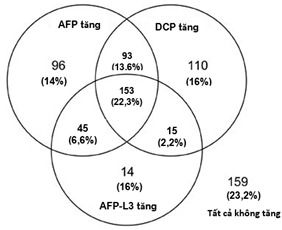
Hình 1. Số bệnh nhân và tỷ lệ tăng của các dấu ấn khối u ở 685 bệnh nhân ung thư biểu mô tế bào gan. Các điểm cắt (cut-off) của các dấu ấn khối u là AFP = 20 ng/dL, AFP-L3 = 10% và DCP =40 mAU/mL (0,48 ng/mL) (Toyoda H, et al, 2006 [8]).
Về giá trị của các dấu ấn khối u trong chẩn đoán sớm HCC, nghiên cứu trên 298 bệnh nhân HCC, Park SJ, et al, 2017 [6], thấy rằng, ở giai đoạn sớm của HCC (giá trị cắt của AFP từ 10 đến 20 ng/mL), các dấu ấn khối u AFP-AFP-L3 và DCP và sự kết hợp của chúng có giá trị rõ rệt trong chẩn đoán sớm HCC (Bảng 6).
Bảng 6. Giá trị của các dấu ấn khối u AFP-AFP-L3 và DCP và sự kết hợp của chúng trong chẩn đoán sớm HCC ở giá trị cắt của AFP từ 10 đến 20 ng/mL (Park SJ, et al, 2017 [6])
|
Dấu ấn khối u
|
Độ nhạy %
|
Đô dặc hiệu %
|
PPV %
|
NPV %
|
Độ chính xác %
|
AUC (95% CI)
|
|
AFP
|
62,03
|
92,21
|
89,09
|
70,30
|
76,92
|
0,77
|
|
AFP-L3
|
50,03
|
83,12
|
75,47
|
62,14
|
66,67
|
0,67
|
|
DCP
|
70,89
|
70,13
|
70,89
|
70,13
|
70,51
|
0,71
|
|
AFP + AFP-L3
|
44,30
|
97,40
|
94,59
|
63,03
|
70,51
|
0,71
|
|
AFP + DCP
|
50,63
|
100, 00
|
100,00
|
66,38
|
75,00
|
0,75
|
|
AFP-L3 + DCP
|
44,30
|
97,40
|
94,59
|
63,03
|
70,51
|
0,71
|
|
AFP + AFP-L3 + DCP
|
37,97
|
100
|
100,00
|
61,11
|
68,59
|
0,69
|
Tóm lại, các xét nghiệm phát hiện sớm ung thư biểu mô tế bào gan (HCC) gồm: AFP, AFP-L3 và DCP. Mặc dù AFP đã được sử dụng đã được sử dụng từ lâu nhưng nó chưa bao giờ được FDA phê chuẩn như một dấu ấn một mình để phát hiện HCC. Sự kết hợp giữa AFP, AFP-L3 và DCP hoặc AFP và DCP, tính theo GALAD score (Wako i30) có thể cải thiện độ chính xác để phát hiện sớm HCC, ngay cả khi khối u ở giai đoạn I, với chỉ khối u và kích thước khối u <2 cm.
Tài liệu tham khảo
1. Alavial SM, Imanieh MHa, and Imanieh MHo. Predictive Factors in the Incidence of Cirrhosis in Chronic Hepatitis B Virus Infections. Hepat Mon 2016; 16(5): e34790.
2. Hadziyannis E and Laras A. Viral Biomarkers in Chronic HBeAg Negative HBV Infection. Genes (Basel) 2018 Oct; 9(10): 469.
3. Luật NN, Quyền NH, Tản ĐV, Hồng VM, Hương NTT, Lan VN và Vân PH. Các đột biến vùng BCP/PC của HBV liên quan với xơ gan và ung thư biểu mô tế bào gan được phát hiện ở bệnh nhân viêm gan B mạn ở Miền Bắc Việt Nam. Tạp chí Gan-Mật Việt Nam 2013; Số 25: 13-19.
4. Luật NN, Quyền NH, Tản ĐV, Hồng VM, Hương NTT, Lan VN và Vân PH. Phát hiện các đột biến kháng thuốc của virus viêm gan B từ các bệnh nhân bị viêm gan B mạn ở miền Bắc Việt Nam. Tạp chí Y học Việt Nam 2014 Tháng 8; 421 (Số đặc biệt): 158-163).
5. Luật NN, Quyền NH, Tản ĐV, Hồng VM, Hương NTT, Lan VN. Sự kết hợp mức độ qHBsAg và HBV DNA để xác định “người mang HBV không hoạt động thật” trong số những bệnh nhân nhiễm HBV mạn được xem là “người mang HBV không hoạt động”. Y học Việt Nam, Tháng 8, 2015; 433: 77-83.
6. Park SJ, Jang JY, Jeong SW, et al. Usefulness of AFP, AFP-L3, and PIVKA-II, and their combinations in diagnosing hepatocellular carcinoma. Medicine (Baltimore) 2017 Mar; 96: e5811.
7. Roberts LR. Biomarkers for Hepatocellular Carcinoma. Gastrenterol Hepatol 2016; 12 (4): 252-255.
8. Toyoda H, Kumada T, Kiriyama S, et al. Prognostic significance of simultaneous measurement of three tumor markers in patients with hepatocellular carcinoma. Clin Gastroenterol Hepatol 2006; 4: 111-117.
9. Wang HW, Peng CY, Lai HC, et al. New noninvasive index for predicting liver fibrosis in Asian patients with chronic viral hepatitis. Scientific reports 2017 Jun; 7: 3259.
10. WHO. Guidelines for the prevention, care and treatment of persons with chronic hepatitis B infection. March 2015: 1-166.


