PGS TS Nguyễn Nghiêm Luật, Bệnh viện Đa khoa MEDLATEC
19/11/2020 | Triệu chứng ung thư đại tràng sớm và cách điều trị 16/09/2020 | Bệnh ung thư đại tràng nguy hiểm như thế nào? 20/07/2020 | Tầm soát ung thư đại tràng với phương pháp CT Scanner 23/05/2020 | Đừng bỏ qua những dấu hiệu cảnh báo sớm ung thư đại tràng
Tóm tắt
1) Theo dữ liệu của Globocan 2020, ung thư đại trực tràng (CRC) là loại ung thư được chẩn đoán phổ biến thứ ba với gần 2 triệu ca mắc mới và là loại ung thư gây tử vong cao thứ hai với hơn 900.000 ca tử vong trên toàn cầu trong năm 2020. Ở Việt Nam, CRC là loại ung thư được chẩn đoán phổ biến thứ năm với hơn 16.000 ca mắc mới trong năm 2020.
2) Một số dấu ấn của ung thư đại trực tràng, gồm kháng nguyên ung thư phôi (CEA), kháng nguyên carbohydrat (CA 19-9), kháng nguyên đặc hiệu polypeptid mô (TPS), glycoprotein liên quan đến khối u-72 (TAG-72) và các yếu tố tăng trưởng tạo máu (HGFs) đã được công nhận và được chấp nhận trong thực hành lâm sàng thường quy.
3) Một số yếu tố tăng trưởng tạo máu (HGFs), chẳng hạn như yếu tố tế bào gốc (SCF), yếu tố kích thích đại thực bào (MCS) và yếu tố kích thích tế bào hạt - đại thực bào (GMCSF) là thành viên của các cytokin glycoprotein có thể được sử dụng làm dấu ấn sinh học cho ung thư đại trực tràng, đặc biệt là khi kết hợp với CEA và CA19-9.
4) Một số enzym như ADH (đặc biệt là ADH-I), cathepsin D và lysosome exoglycosidases, N-acetyl-β-D hexosaminidase và ornithine decarboxylase (ODC) cũng có thể được sử dụng trong chẩn đoánvà tiên lượng ung thư đại trực tràng.
5) Các dấu ấn sinh thiết lỏng đầy hứa hẹn cho ung thư đại trực tràng là:
- CTCs (các tế bào khối u tuần hoàn): phân tích CTCs, yếu tố gây di căn, có thể là nguồn thông tin hữu ích trong theo dõi điều trị bệnh nhân ung thư đại trực tràng.
- Các DNA khối u tuần hoàn (ctDNAs): phân tích ctDNA có thể hữu ích để chẩn đoán ung thư đại trực tràng ở giai đoạn sớm, phát hiện u sót lại tối thiểu và phát hiện sớm tái phát sau phẫu thuật, cũng có thể hữu ích để dự đoán các đáp ứng hóa trị liệu sớm và theo dõi sự kháng thuốc thứ phát của hóa trị liệu ở những bệnh nhân bị di căn.
- Các miRNA tuần hoàn (miRNA): các miRNA do tế bào khối u tiết ra máu, có thể được sử dụng làm dấu ấn sinh học hứa hẹn trong chẩn đoán, theo dõi và tiên lượng ung thư đại trực tràng.
- Các túi ngoại bào: các miRNA túi ngoại bào (miR-23a, miR-21,…), các RNA không mã hóa chuỗi dài túi ngoại bào (lncRNAs), các protein túi ngoại bào (CD147 (+), CPNE3,…) được tách từ các túi ngoại bào, cũng có thể được sử dụng làm dấu ấn sinh học cho chẩn đoán, theo dõi và tiên lượng ung thư đại trực tràng.
The value of biomarkers in diagnosis, monitoring and prognosis of colorectal cancer
Luat Nghiem Nguyen
MEDLATEC General Hospital
Abstract
1) According to Globocan 2020 data, colorectal cancer (CRC) is the third most commonly diagnosed cancer with nearly 2 million new cases and is the second most deadly cancer with more than 900,000 deaths were seen globally in 2020. In Vietnam, CRC is the fifth most commonly diagnosed cancer with more than 16,000 new cases in 2020.
2) Several markers of colorectal cancer, including carcinoembryonic antigen (CEA), carbohydrate antigen (CA 19.9), tissue polypeptide specific antigen (TPS), tumor-associated glycoprotein-72 (TAG-72), and hematopoietic growth factors (HGFs) have been recognized and are accepted in routine clinical practice.
3) Some hematopoietic growth factors (HGFs), such as stem cell factor (SCF), macrophage-colony stimulating factor (M-CSF) and granulocyte-macrophage-colony stimulating factor (GM-CSF) are members of glycoprotein cytokines can be used as biomarkers for colorectal cancer, especially in combination with CEA and CA19-9.
4) Some various enzymes such as ADH (especially ADH I), cathepsin D và lysosomal exoglycosidases, N-acetyl-β-D-hexosaminidase, and ornithine decarboxylase (ODC) may be also used in the diagnosis and prognosis of colorectal cancer.
5) The promising liquid biopsy markers for colorectal cancer are the following:
- CTCs (circulating tumor cells): analysis of CTCs, factors responsible for metastasis, may be a source of information useful in the treatment monitoring of patients with colorectal cancer.
- ctDNAs (circulating tumor DNAs): ctDNA analysis can be useful to detect cancer at an early stage in patients, to detect minimal residual disease, and to detect early relapse after curative surgery; it can also be useful to predict early chemotherapeutic responses and to monitor secondary resistance of chemotherapy in patients with metastasis.
- miRNAs (circulating miRNAs): miRNAs secreted by tumor cells in circulation, could be used as promising biomarkers in diagnosis, monitoring, and prognosis of colorectal cancer.
- Exosomes: exosomal miRNAs (miR-23a, miR-21, …), exosomal long non-coding RNAs (exosomal lncRNAs), exosomal proteins (CD147(+), CPNE3, …) were extracted from exosomes may be also used as biomarkers for diagnosis, monitoring, and prognosis of colorectal cancer.
Theo Globocan - một dự án của Cơ quan Nghiên cứu Ung thư Quốc tế (International Agence on Cancer Research-IACR) trực thuộc Tổ chức Y tế Thế Giới (WHO) (WHO, Globocan, Colorectal cancer 2020 [11]), trong năm 2020, trên thế giới, tính theo cả hai giới và ở các độ tuổi, ung thư đại trực tràng (colorectal cancer: CRC) là loại ung thư phổ biến thứ 3 (10%) với 1.931.590 ca mắc mới, sau ung thư vú (11,4%) và ung thư phổi (11,4%) và đứng thứ 2 về tử vong (9,4%) với 935.173 ca tử vong, sau ung thư phổi (18,0%). Cũng theo Globocan 2020 (WHO, Globocan, Vietnam 2020 [12]), trong năm 2020, ở Việt Nam, tính theo cả hai giới và ở các độ tuổi, ung thư đại trực tràng là loại ung thư phổ biến thứ 5 (9%) với 16.426 ca mắc mới, sau các ung thư gan (14,5%), phổi (14,4%), vú (11,8%) và dạ dày (9,8%). Nếu không được kiểm soát, dự kiến đến năm 2030 sẽ có hơn 2,2 triệu ca mắc mới và 1,1 triệu ca tử vong. Vì vậy, ung thư đại trực tràng đã trở thành mối đe dọa nghiêm trọng đối với sức khỏe con người.
Ung thư ung thư đại trực tràng là sự phát triển không kiểm soát được của các tế bào bất thường trong các lớp mô lót đại tràng. Phần lớn ung thư đại trực tràng là ung thư biểu mô tuyến. Hầu hết các trường hợp ung thư đại trực tràng bắt đầu với sự phát triển của một số loại khối u lành tính được gọi là u tuyến, phát triển nhô vào khoang ruột. Những khối u này tương đối phổ biến ở những người trên 50 tuổi và hầu hết đều lành tính. Các khối u của đại trực tràng có nguy cơ trở thành ung thư ở các mức độ khác nhau. Trong khi tỷ lệ mắc ung thư đại trực tràng giảm gần đây ở những người từ 55 tuổi trở lên do việc tầm soát được cải thiện, thì tỷ lệ ung thư đại trực tràng và tử vong ở người dưới 50 tuổi tăng lên 51%. Vì vậy, độ tuổi bắt đầu được khuyến nghị để tầm soát ung thư đại trực tràng được hạ từ 50 tuổi xuống 45 tuổi.
Các yếu tố nguy cơ của ung thư đại trực tràng có thể gồm: nguy cơ tăng lên theo tuổi tác, thừa cân hoặc béo phì, cũng có thể do di truyền (có người trong gia đình bị ung thư đại trực tràng hoặc nhiều polyp), chế độ ăn uống (nhiều chất béo, thịt, không ăn đủ trái cây, rau hoặc thực phẩm giàu chất xơ), lối sống (hút thuốc lá, uống quá nhiều rượu và ít tập thể dục), viêm loét đại tràng, đái tháo đường loại 2, chủng tộc (người Mỹ gốc Phi), mắc bệnh di truyền hiếm gặp đa polyp tuyến gia đình (FAP) hoặc hội chứng Lynch.
Các dấu hiệu và triệu chứng của ung thư đại trực tràng có thể gồm: bệnh thường không có các dấu hiệu hoặc triệu chứng ở giai đoạn sớm. Khi bệnh tiến triển, các dấu hiệu và triệu chứng có thể xảy ra, chẳng hạn như: tiêu chảy, táo bón, phân hẹp hơn bình thường hoặc ỉa chảy kéo dài trên10 ngày, chảy máu trực tràng, có máu trong phân (màu đỏ tươi hoặc sẫm), mót đại tiện, thiếu máu do thiếu sắt, đau bụng dưới, khó chịu ở bụng (đầy hơi, chướng bụng, chuột rút), sút cân không rõ lý do, mệt mỏi liên tục. Nếu ung thư đại trực tràng được phát hiện sớm, tỷ lệ chữa khỏi có thể lên đến 90% số trường hợp.
Bài viết này cập nhật về giá trị của các dấu ấn sinh học trong sàng lọc, chẩn đoán, theo dõi và tiên lương ung thư đại trực tràng.
1. Các dấu ấn khối u cổ điển (Classical tumor markers)
1.1. Carcinoembryonic antigen (CEA):
CEA là tên viết tắt của kháng nguyên ung thư phôi (carcinoembryonic antigen), một glycoprotein có thành phần carbohydrat chiếm khoảng 50%, được biểu hiện trong nhiều loại khối u biểu mô. 70% bệnh nhân ung thư đại trực tràng có nồng độ CEA tăng tại thời điểm chẩn đoán, điều này làm cho nó trở thành một dấu hiệu tốt cho việc theo dõi hiệu quả điều trị phẫu thuật. Tuy nhiên CEA cũng có thể tăng trong nhiều bệnh lành tính, như trong viêm gan, viêm tụy, bệnh phổi tắc nghẽn và viêm ruột. Nồng độ tham chiếu của CEA huyết thanh là <5 ng/mL. Thời gian bán hủy của CEA là khoảng 7 ngày. Ở người hút thuốc, viêm loét đại tràng hoặc xơ gan, nồng độ CEA cũng có thể tăng lên đến 10 ng/mL. Nồng độ CEA cao trước phẫu thuật có thể liên quan với tiên lượng xấu. Sau phẫu thuật cắt bỏ khối u, mức độ CEA sẽ trở về bình thường trong vòng 4 đến 6 tuần. Nồng độ CEA tăng cao liên tục có thể là dấu hiệu của xâm lấn hoặc di căn. Nồng độ CEA tăng chậm sau phẫu thuật là dấu hiệu điển hình của tái phát tại chỗ, trong khi nồng độ tăng tự phát có thể là triệu chứng của di căn, hầu hết là ở gan. Bệnh nhân được điều trị ung thư đại trực tràng nên được theo dõi nồng độ CEA 3 tháng một lần (Lech G, 2016 [6]).
1.2. CA 19-9 (kháng nguyên carbohydrat):
CA 19-9 là một kháng nguyên glycoprotein. CA19-9 có thể tăng trong ung thư tụy hoặc dạ dày. Các nghiên cứu cho thấy độ nhạy CA 19-9 kém hơn nhiều so với CEA (Lech G, 2016 [6]). Sự kết hợp giữa CEA và CA 19-9 có thể làm tăng độ nhạy chẩn đoán ung thư đại trực tràng. Việc xác định cả hai dấu ấn này có thể được sử dụng như một yếu tố tiên lượng sau phẫu thuật.
1.3. Kháng nguyên đặc hiệu polypeptid mô (tissue polypeptide specific antigen: TPS):
Kháng nguyên đặc hiệu polypeptid mô (TPS) là một dấu ấn khối u hữu ích trong chẩn đoán theo dõi hóa trị liệu của nhiều loại ung thư đường tiêu hóa khác nhau. TPS là một chuỗi polypeptid liên hợp đơn lẻ, được tạo ra trong các giai đoạn khác nhau của chu trình phân tử (S hoặc G2) và được giải phóng vào mô sau khi phân bào. Nồng độ TPS cao là dấu hiệu về sự tăng cường hoạt động của khối u, của sự tăng sinh và tốc độ phân chia tế bào ung thư. Mức độ cao của TPS xuất hiện ở khoảng 60-80% bệnh nhân CRC. Việc xác định lặp lại nồng độ TPS trong điều trị có thể giúp theo dõi hiệu quả điều trị và đánh giá tiên lượng (Jelski W, 2020 [5]).
1.4. Glycoprotein liên quan đến khối u-72 (tumor-associated glycoprotein-72: TAG-72):
TAG-72 là một glycoprotein được hình thành trong tế bào nội mô ống mật, biểu mô dạ dày hoặc tế bào bể thận. Nó là một phân tử giống mucin với khối lượng phân tử trên 1000 kDa. TAG-72 được thấy trên bề mặt của nhiều loại tế bào ung thư, bao gồm ung thư đại trực tràng, buồng trứng, vú và tụy. Nghiên cứu đã chỉ ra rằng nồng độ huyết thanh của TAG-72, CEA, CA 19-9 tăng lên tương ứng ở 43%, 43% và 27% số bệnh nhân ung thư đại trực tràng. Nên xác định TAG-72 cùng với các dấu ấn khối u khác, chủ yếu là với CEA. 61% số bệnh nhân CRC có ít nhất một trong 3 dấu ấn này tăng (Jelski W, 2020 [5]).
2. Các yếu tố tăng trưởng tạo máu (hematopoietic growth factors: HGFs)
Tế bào ung thư đại trực tràng có khả năng tạo ra các yếu tố tăng trưởng tạo máu (HGFs). Các yếu tố tăng trưởng tạo máu (HGFs) gồm: yếu tố tế bào gốc (stem cell factor: SCF), yếu tố kích thích đại thực bào (macrophage-colony stimulating factor: M-CSF) và yếu tố kích thích bạch cầu hạt-đại thực bào (granulocyte-macrophage-colony stimulating factor: GM-CSF). Các yếu tố tăng trưởng tạo máu có liên quan đến việc điều hòa sự phát triển và di căn của ung thư. HGFs điều chỉnh sự tăng sinh của các tế bào tiền thân tạo máu và cũng có thể ảnh hưởng đến sự tăng sinh của các tế bào không tạo máu. Các thụ thể bề mặt tế bào đối với HGF đã được phát hiện ở các dòng tế bào CRC và sự kích thích tăng sinh tế bào khối u xảy ra thông qua các thụ thể này. HGF có thể hoạt động trên mô ung thư và mạch máu để tạo ra môi trường thuận lợi cho sự phát triển của ung thư. Các thụ thể của HGF đã được phát hiện ở các dòng tế bào ung thư đại trực tràng và sự kích thích của các thụ thể CSF gây ra sự tăng sinh của các tế bào khối u. Nồng độ M-CSF trong máu và yếu tố kích thích tế bào bạch cầu hạt (G-CSF) ở bệnh nhân CRC cao hơn đáng kể so với đối chứng. Mức độ của cả hai chất chỉ điểm phụ thuộc vào giai đoạn của khối u, nhưng chỉ M-CSF cho thấy sự khác biệt đáng kể. Nồng độ M-CSF huyết thanh cao hơn ở những bệnh nhân có di căn hạch hoặc di căn xa. Độ đặc hiệu và độ nhạy chẩn đoán của M-CSF lần lượt là 95% và 65%. Tất cả các tiêu chuẩn chẩn đoán như độ nhạy, độ đặc hiệu và AUC đối với G-CSF đều thấp hơn so với M-CSF. Do đó, M-CSF được xem như là một chất chỉ điểm tốt hơn G-CSF trong chẩn đoán và tiên lượng CRC. Có sự tăng của một số cytokin tiền viêm, như interleukin-6 (IL 6), interleukin-8 (IL 8), yếu tố hoại tử khối u-α (TNF-α) và các protein giai đoạn cấp ở bệnh nhân ung thư đại trực tràng. Nghiên cứu cũng cho thấy vai trò tiềm năng của yếu tố tế bào gốc (SCF) và interleukin-3 (IL 3) như là dấu ấn khối u đối với CRC, đặc biệt là khi kết hợp với CEA và CA19-9 (Jelski W, 2020 [5]).
3. Các enzym (enzymes)
Một số nghiên cứu gần đây về việc sử dụng các enzym làm chất chỉ điểm cho CRC, bao gồm alcohol dehydrogenase (ADH), cathepsin D và lysosomal exoglycosidases cho thấy hoạt độ của alcohol dehydrogenase trong tế bào ung thư cao hơn đáng kể so với ở mô khỏe mạnh, trong khi hoạt độ của aldehyde dehydrogenase (ALDH) không khác nhau giữa các mô khỏe mạnh và ung thư. Điều này cho thấy các tế bào ung thư có khả năng oxy hóa ethanol lớn hơn và khả năng loại bỏ acetaldehyd ít hơn đáng kể so với các mô khỏe mạnh. Các nghiên cứu cho thấy chỉ có hoạt động của ADH I (isoenzym của alcohol dehydrogenase) ở tế bào CRC cao hơn rõ rệt so với ở các tế bào đại trực tràng khỏe mạnh. Sự tăng hoạt độ toàn phần của alcohol dehydrogenase có sự tương quan thuận với isoenzym loại I của ADH. Hoạt độ ADH và ADH I huyết thanh có xu hướng cao hơn ở bệnh nhân CRC giai đoạn nặng hơn. ADH I có độ nhạy chẩn đoán là 76%, độ đặc hiệu là 82%, giá trị tiên đoán dương tính và âm tính lần lượt là 85% và 74%, và AUC là 0,72 (Jelski W, 2020 [5]). Sự phát triển và di căn của CRC có thể được hỗ trợ bởi các exoglycosidase do đại thực bào tiết ra. Có sự tăng rõ rệt của N-acetyl-β-D-hexosaminidase, hoạt độ isoenzym A và B của nó trong máu và nước tiểu ở bệnh nhân CRC. Mức độ của cathepsin D cũng tăng trong CRC. Các exoglycosidase của lysosom là không đặc hiệu, hoạt độ của chúng cũng cao trong các bệnh ung thư khác, như ung thư tuyến giáp, thận, tụy, buồng trứng, cũng như trong các bệnh như viêm khớp vô căn, tăng huyết áp, viêm cầu thận hoặc sau ghép gan. Hoạt độ của ornithine decarboxylase (ODC) cao hơn trong CRC, tăng dần từ bình thường, qua u tuyến, đến ung thư.
4. Các dấu ấn sinh học dựa trên sinh thiết lỏng (liquid biopsy-based biomarkers)
Sinh thiết chất lỏng (fluid biopsy), còn gọi là sinh thiết pha lỏng (fluid phase biopsy), là việc lấy mẫu và phân tích các mô lỏng, chủ yếu là máu. Giống như sinh thiết truyền thống, loại sinh thiết này chủ yếu được sử dụng như một công cụ chẩn đoán và theo dõi các bệnh ung thư, nhưng có lợi ích là không xâm lấn, không gây đau, có thể được thực hiện lặp lại để có thể theo dõi tốt hơn sự tiến triển của khối u và các đột biến trong một khoảng thời gian. Nó cũng có thể được sử dụng để xác nhận hiệu quả của một loại thuốc điều trị ung thư bằng cách lấy nhiều mẫu sinh thiết lỏng trong vài tuần hoặc để theo dõi tái phát ung thư sau điều trị (Hauptman N, 2017 [4], Vacante M, 2020 [9], Ding Y, 2020 [2])
Các dấu ấn sinh học của sinh thiết lỏng gồm: các tế bào khối u lưu hành (circulating tumor cells: CTCs), các DNA khối u lưu hành trong máu tuần hoàn (circulating tumor DNAs: ctDNAs), các microRNA lưu hành trong máu tuần hoàn (circulating miRNAs) và các túi ngoại bào (exosomes) (Ding Y, 2020 [2]). Khi tế bào khối u chết, chúng giải phóng ctDNA vào máu. Các đột biến ung thư trong ctDNA phản ánh những đột biến được thấy trong sinh thiết khối u truyền thống, cho phép chúng được sử dụng làm dấu ấn sinh học để theo dõi bệnh.
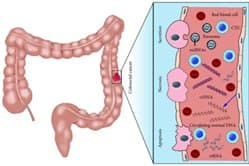
Hình 1. Các tế bào khối u tuần hoàn (CTC), các DNA khối u lưu hành (ctDNAs), các RNA khối u tuần hoàn (ctRNA) và dấu ấn sinh học của các túi ngoại bào (exosomes) là những dấu ấn sinh thiết lỏng đầy hứa hẹn cho ung thư đại trực tràng (Ding Y, 2020 [2]).
4. 1. Các tế bào khối u tuần hoàn (CTCs)
Các tế bào khối u tuần hoàn (CTCs) là các tế bào khối u từ khối u nguyên phát hoặc di căn xâm nhập vào hệ thống tuần hoàn. Một số CTCs có thể thoát khỏi sự nhận biết miễn dịch của cơ thể và điều trị bằng thuốc, thấy vi môi trường thích hợp trong cơ thể và hình thành “mầm bệnh” để phát triển ở mô chính hoặc mô ở xa, gây ra sự tái phát hoặc di căn của khối u. Các CTC trong máu lần đầu tiên được Thomas Ashworth phát hiện năm 1869 ở bệnh nhân có khối u di căn. Năm 1955, người ta đã chứng minh sự hiện diện của các CTC trong máu tuần hoàn. Tuy nhiên, các CTC vẫn chưa đi vào thực hành lâm sàng, chủ yếu là do thách thức về kỹ thuật phân lập các tế bào cực kỳ hiếm này từ máu ngoại vi (Ding Y, 2020 [2]).
Cách làm giàu các tế bào khối u tuần hoàn (CTCs): số lượng các CTC được phát hiện trong máu ngoại vi là rất ít, chỉ có khoảng 1 tế bào khối u/ 107 tế bào bạch cầu trong máu tuần hoàn, và thường chỉ có từ 1 đến 10 tế bào khối u/mL máu toàn phần được phát hiện ở bệnh nhân ung thư di căn, vì vậy việc phát hiện chính xác CTC rất khó khăn. Về nguyên tắc, có nhiều phương pháp khác nhau để phát hiện CTC trên cơ sở các đặc tính sinh học hoặc vật lý của chúng. Công nghệ sinh học chủ yếu đề cập đến khả năng tách chúng bằng kỹ thuật miễn dịch. Công nghệ tách CTC từ miễn dịch kết hợp các kháng nguyên trên bề mặt tế bào với các hạt từ tính gắn với kháng thể đặc hiệu và làm giàu tế bào dưới tác dụng của từ trường bên ngoài. Hệ thống tìm kiếm tế bào sử dụng các hạt từ tính để liên kết các kháng nguyên đặc hiệu để tách các tế bào biểu mô trong máu, và nguyên tắc chính của nó là tách các CTC bằng cách sàng lọc các tế bào CK+, DAPI+, và CD45-. Hệ thống này là máy dò CTC duy nhất đã được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) chấp thuận cho các nghiên cứu lâm sàng ở bệnh nhân ung thư vú, đại trực tràng và tuyến tiền liệt. Các CTC cũng có thể được phân tách theo mật độ, kích thước và khả năng biến dạng theo các đặc tính vật lý của công nghệ làm giàu CTC. Các CTC còn có thể được phân tách bằng ly tâm gradient mật độ, tách lọc màng, phát hiện vi chất lỏng và các phương pháp vật lý khác không làm hỏng cấu trúc của tế bào và các tế bào được tách có thể tiếp tục được sử dụng trong các xét nghiệm hóa mô miễn dịch hoặc miễn dịch huỳnh quang.
Giá trị áp dụng của các dấu ấn sinh học của các tế bào khối u tuần hoàn (CTCs) trong sàng lọc, chẩn đoán, theo dõi điều trị và tiên lượng ung thư đại trực tràng được thể hiện ở Bảng 1.
Bảng 1. Giá trị áp dụng của các tế bào ung thư tuần hoàn (ctCTCs) trong ung thư đại trực tràng (Ding Y, 2020 [2]).
|
TT
|
Dấu ấn sinh học của CTCs
|
Phương pháp
|
Ứng dụng lâm sàng
|
|
1
|
CD45
|
Scrm PCR
|
Sàng lọc và phát hiện sớm
|
|
2
|
EpCAM
|
Cell Search™
|
Tiên lượng
|
|
3
|
CD45
|
Cyttel
|
Dự đoán và tiên lượng
|
|
4
|
CK-19, EpCAM
|
CK19-Epispot và CellSearch™
|
Tiên lượng
|
|
5
|
EpCAM, APC, KRAS, PIK3CA
|
NGS, CGH, CellSearch™
|
Theo dõi điều trị và tái phát
|
|
6
|
KRAS
|
qPCR dựa trên PNA
|
Theo dõi điều trị
|
|
7
|
LGR5, EMT
|
CanPatrol™, mRNA ISH
|
Tiên lượng
|
|
8
|
CMx CK20
|
CMx platform
|
Giám sát tái phát sớm
|
|
9
|
EpCAM
|
CellSearch™
|
Dự đoán và tiên lượng
|
Các chữ viết tắt: PCR scrm (single-cell RNA and mutational analysis PCR): PCR phân tích RNA của một tế bào riêng lẻ và đột biến; NGS (next-generation sequencing): giải trình tự thế hệ tiếp theo; CGH (array-comparative genomic hybridization): lai ghép bộ gen so sánh mảng; qPCR dựa trên PNA (PNA-based qPCR: peptide nucleic acid-based real-time PCR): PCR thời gian thực dựa trên acid nucleic của peptide; mRNA ISH (mRNA in situ hybridization): lai tại chỗ mRNA.
4.2. DNA khối u tuần hoàn (circulating tumor DNA: ctDNA)
Các DNA khối u tuần hoàn (circulating tumor DNAs: ctDNA) là các đoạn DNA sợi kép có nguồn gốc từ tế bào khối u, có khối lượng phân tử từ 0,18 đến 21 kb (Galvano A, 2019 [3]). Chúng chủ yếu được thấy trong máu, dịch khớp, dịch não tủy, nước bọt, nước tiểu và phân, với hàm lượng cực kỳ nhỏ. Sự hiện diện của ctDNA có thể có từ những nghiên cứu ban đầu về DNA tự do lưu hành (circulating free DNA: cfDNA). cfDNA được coi là có nguồn gốc chủ yếu từ các tế bào hoại tử hoặc tế bào chết được lập trình (apoptotic). Bệnh nhân ung thư có lượng cfDNA cao hơn nhiều so với người khỏe mạnh. Trong một số tình trạng sinh lý hoặc bệnh lý khác, nồng độ cfDNA cũng tăng lên, như khi tập thể dục, nhiễm khuẩn, nhồi máu não, chấn thương cấp tính, và cấy ghép. ctDNA là một phần của cfDNA được giải phóng từ các tế bào khối u vào máu, nó mang các đột biến đặc hiệu tương tự như các tế bào ung thư tương ứng, chẳng hạn như các proto-oncogene của khối u và các đột biến gen sinh ung thư và sự methyl hóa DNA.
Các phương pháp phát hiện ctDNA: hiệu quả tách chiết của ctDNA khó đạt yêu cầu do chúng có kích thước nhỏ, hàm lượng thấp, dễ kết hợp với protein huyết tương. Công nghệ phát hiện ctDNA thường dựa trên hai nền tảng chính là phản ứng chuỗi polymerase định lượng (quantitative polymerase chain reaction: qPCR) và giải trình tự gen thế hệ mới (next-generation sequencing: NGS). Các phương pháp dựa trên PCR định lượng (qPCR-based methods) được sử dụng rộng rãi để phát hiện đột biến gen trong DNA tự do (cfDNA), tuy nhiên, độ nhạy của nó không đến 0,1%. Gần đây, các phương pháp dựa trên qPCR được cải tiến đã trở nên khả thi. qPCR đặc hiệu cho alen đã được phát minh để phát hiện các đột biến điểm nóng (hotspot mutations) trong huyết tương bệnh nhân ung thư với độ nhạy từ 0,014% đến 0,004%. Năm 1999, PCR kỹ thuật số (digital PCR: dPCR) có độ nhạy cao hơn, có thể giúp xác định và định lượng chính xác các đoạn đột biến hiếm gặp và xác định định lượng mức độ ctDNA. dPCR dựa trên picodroplet có khả năng phát hiện chính xác một gen KRAS đột biến trong hơn 200.000 gen KRAS kiểu hoang dã. Giải trình tự thế hệ mới (NGS) là một kỹ thuật giải trình tự song song hàng loạt có thể phân tích các mục tiêu lớn hơn. Nó không chỉ có thể phát hiện các gen đã biết mà còn phân tích một cách vô tình các phần lớn các bộ gen và xác định nhiều đột biến với độ nhạy cao hơn. Do tốc độ nhanh và thông lượng lớn của NGS và số lượng mẫu DNA nhỏ cần sử dụng, nó ngày càng được ứng dụng nhiều hơn trong lĩnh vực lâm sàng ung thư, chẳng hạn như giải trình tự bảng gen, giải trình tự exom và giải trình tự toàn bộ bộ gen. Giải trình tự cfDNA từ các mẫu huyết tương nối tiếp có thể được sử dụng để mô tả bản đồ gen tiến hóa của toàn bộ các đột biến exon. Giải trình tự toàn bộ bộ gen của cfDNA được giải phóng từ các tế bào khối u vào máu có thể giúp phát hiện các đột biến của khối u như sự khuếch đại khu trú, sự sắp xếp lại gen và quang sai nhiễm sắc thể. Những tiến bộ trong công nghệ NGS đã mở rộng khả năng phát hiện đột biến ung thư trong máu và làm phong phú thêm ứng dụng lâm sàng của sinh thiết lỏng dựa trên ctDNA. So với dPCR, NGS có khả năng phân tích các vùng mục tiêu lớn hơn để phát hiện các đột biến hiếm gặp trong phạm vi 0,1% hoặc nhỏ hơn của đoạn DNA đột biến. Dựa trên những ưu điểm và nhược điểm của dPCR và NGS, chúng có thể bổ sung cho nhau trong các ứng dụng lâm sàng thực tế (Ding Y, 2020 [2]).
Giá trị của các DNA khối u trong máu tuần hoàn (ctDNAs) trong sàng lọc, chẩn đoán, theo dõi điều trị và tiên lượng ung thư đại trực tràng được thể hiện ở Bảng 2.
Bảng 2. Giá trị áp dụng của các dấu ấn sinh học của các DNA khối u tuần hoàn (ctDNAs) trong ung thư đại trực tràng (Ding Y, 2020 [2]).
|
TT
|
Dấu ấn sinh học của ctDNA
|
Phương pháp
|
Ứng dụng lâm sàng
|
|
1
|
SEPT9 được metyl hóa
|
qPCR
|
Sàng lọc
|
|
2
|
TP53, PIK3CA, APC, EGFR
|
Giải trình tự đích
|
Chẩn đoán sớm và phân giai đoạn bổ trợ của CRC
|
|
3
|
KRAS
|
454pyrosequences, BEAMing
|
Lựa chọn và theo dõi điều trị
|
|
4
|
SSVs
|
ddPCR
|
Tiên lượng và giám sát
|
|
5
|
Một bảng gồm 15 gen
|
Sev- Seqs
|
Tiên lượng
|
|
6
|
KRAS, PIK3CA, BRAF
|
BEAMing
|
Tiên lượng
|
|
7
|
KRAS
|
dPCR
|
Tiên lượng và theo dõi kháng thuốc
|
|
8
|
Các kiểu đột biến và VAFs
|
NGS
|
Theo dõi mức độ khối u
|
|
9
|
KRAS, NRAS
|
Giải trình tự Sanger hai chiều
|
Lựa chọn và theo dõi điều trị
|
|
10
|
KRAS
|
ddPCR
|
Theo dõi kháng thuốc
|
|
11
|
KRAS
|
BEAMing, ddPCR, NGS
|
Lựa chọn và theo dõi điều trị
|
|
12
|
SSV, SPM
|
ddPCR
|
Phát hiện bệnh tồn lưu tối thiểu và dự đoán tái phát
|
|
13
|
TP53, APC, KRAS
|
Safe-Seqs
|
Phát hiện bệnh tồn lưu tối thiểu và dự đoán tái phát
|
|
14
|
BCAT1 được methyl hóa và IKZF1
|
Triplex qPCR thời gian thực
|
Phát hiện bệnh tồn lưu tối thiểu và lựa chọn điều trị
|
Các chữ viết tắt: qPCR: real-time PCR; SSVs (somatic structural variants): các biến thể cấu trúc soma; ddPCR (droplet digital PCR): PCR kỹ thuật số dạng giọt; Safe-Seqs (Safe-Sequencing system): hệ thống giải trình tự an toàn; dPCR (digital PCR): PCR kỹ thuật số; NGS (next-generation sequencing): giải trình tự thế hệ tiếp theo; VAFs (variant allele frequencies): tần số alen biến thể; SPMs (somatic point mutations): đột biến điểm soma; MRD (minimal residual disease): bệnh tồn lưu tối thiểu.
4.3. Các micrRNA tuần hoàn (circulating microRNAs)
Các microRNA tuần hoàn thuộc nhóm RNA ổn định sợi đơn nhỏ không mã hóa (small-non-coding single-strand stable RNAs), có độ dài khoảng 20-24 nucleotid và đóng một vai trò thiết yếu trong quá trình điều hòa sau phiên mã của các gen sinh vật nhân chuẩn. Các phân tử nhỏ này tham gia tích cực vào cả quá trình sinh lý và bệnh lý của tế bào, gồm cả sự biến đổi ác tính. Chúng đóng vai trò quan trọng trong nhiều quá trình sinh học, như tăng sinh tế bào, biệt hóa và apoptosis (Hauptman N and Glavač D, 2017 [4], Rapado-González Ó, 2019 [8]). Các kỹ thuật hàng đầu để nghiên cứu sự biểu hiện của miRNA gồm phiên mã ngược định lượng-PCR (qRT-PCR), microarrays và giải trình tự thế hệ mới (NGS). Về lợi ích lâm sàng của các miRNA lưu hành trong việc phát hiện CRC sớm, hiệu suất chẩn đoán có thể được tăng đáng kể bằng cách phát hiện đồng thời nhiều loại miRNA. Trong ung thư đại trực tràng, việc xét nghiệm nhiều miRNA cho thấy độ chính xác chẩn đoán cao hơn (độ nhạy 84%, độ đặc hiệu 87%, AUC 0,92) so với đánh giá của một miRNA đơn lẻ (độ nhạy 78% và độ đặc hiệu 78%, AUC 0,84).
4.4. Các túi ngoại bào (exosomes)
Túi ngoại bào (exosomes) là những túi nhỏ có màng kép lipid (lipid bilayer membrane vesicles), đường kính 30-100 nm, được tiết ra từ nhiều loại tế bào khác nhau trong điều kiện sinh lý và bệnh lý, tồn tại trong các chất lỏng sinh học khác nhau, chẳng hạn như máu, nước tiểu và nước bọt. Túi ngoại bào chứa nhiều loại phân tử như các DNA, mRNA, miRNA và lncRNA), phản ánh tình trạng sinh lý hoặc bệnh lý của tế bào chủ. Chức năng sinh học của các dấu ấn sinh học của túi ngoại bào của các tế bào có nguồn gốc ung thư trong sự chuyển gen giữa các tế bào ung thư đã dần được khẳng định và trở thành điểm nóng trong nghiên cứu và thực hành ung thư.
4.4.1. Các miRNA của túi ngoại bào (exosomal miRNAs)
Các miRNA của túi ngoại bào là các RNA nhỏ không mã hóa, dài khoảng 18-25 nucleotid. Một số miRNA được biểu hiện khác nhau trong túi ngoại bào của bệnh nhân ung thư đại trực tràng có thể là dấu ấn sinh học tiềm năng để chẩn đoán. Gần đây, 7 miRNA (miR-23a, miR-1246, let-7a, miR-1229, miR-150, miR-223 và miR-21) đã được thấy biểu hiện cao trong các túi ngoại bào huyết thanh của bệnh nhân ung thư đại trực tràng, nhưng giảm đáng kể sau khi cắt bỏ khối u. Trong số 7 miRNA này, 3 miRNA là miR-23a, miR-1246 và miR-21 có độ chính xác chẩn đoán đối với ung thư đại trực tràng tốt hơn các miR-khác. Diện tích dưới đường cong (AUC) của miR-23a, miR-1246 và miR-21 lần lượt là 0,953, 0,948 và 0,798 (Xiao Y, 2020 [10]).
4.4.2. Các RNA dài không mã hóa của túi ngoại bào (long non-coding RNAs: lncRNAs)
lncRNA là các RNA dài không mã hóa của túi ngoại bào có chiều dài lớn hơn 200 nucleotid, được biểu hiện khác nhau trong các túi ngoại bào của bệnh nhân ung thư đại trực tràng. Người ta thấy rằng sự biểu hiện quá mức (overexpression) của tân sinh đại trực tràng của lncRNA trong các túi ngoại bào huyết thanh của bệnh nhân ung thư đại trực tràng có thể đóng vai trò như một dấu ấn sinh học tiềm năng. AUC của CRNDE-h (colorectal neoplasia differentially expressed-h, một loại lncRNA) là 0,892, trong khi của CEA huyết thanh chỉ là 0,688. Sự kết hợp giữa CRNDE-h và CEA có giá trị chẩn đoán tốt hơn (AUC=0,913) so với CRNDE-h hoặc CEA một mình (Xiao Y, 2020 [10]).
4.4.3. Các protein của túi ngoại bào (exosomal proteins)
Nhiều nghiên cứu cho thấy có sự biểu hiện khác nhau của các protein trong túi ngoại bào trong huyết tương của bệnh nhân ung thư đại trực tràng. Trong một nghiên cứu gần đây, 36 protein đã được tìm thấy được điều chỉnh lên (upregulated) và 22 protein được điều chỉnh xuống (downregulated) trong các túi ngoại bào của bệnh nhân ung thư đại trực tràng. Các protein được điều chỉnh lên tham gia vào các quá trình điều hòa vi môi trường của quá trình di căn, trong khi các protein điều chỉnh xuống chủ yếu tham gia vào sự phát triển và tồn tại của tế bào khối u (Xiao Y, 2020 [10]). Protein sốc nhiệt 60 (heat shock protein 60: Hsp60) trong túi ngoại bào huyết tương là một ứng cử viên đầy hứa hẹn cho chẩn đoán ung thư đại trực tràng. Có sự tăng đáng kể của các túi ngoại bào dương tính với protein xuyên màng CD147 (transmembrane protein CD147) huyết tương của bệnh nhân ung thư đại trực tràng với AUC là 0,932. Ngoài ra, protein copine III (CPNE3) trong các túi ngoại bào của bệnh nhân cũng có thể là một dấu hiệu sinh học hiệu quả để chẩn đoán ung thư đại trực tràng với AUC = 0,791.
Giá trị áp dụng của các miRNA của túi ngoại bào trong ung thư đại trực tràng được chỉ ra ở Bảng 3.
Bảng 3. Giá trị áp dụng của các miRNA của túi ngoại bào trong ung thư đại trực tràng (Ding Y, 2020 [2]).
|
TT
|
Các miRNA của exosom
|
Phương pháp
|
Thay đổi biểu hiện
|
Áp dụng lâm sàng
|
|
1
|
miR-21
|
Phân tích không khuếch đại phát hiện điện hóa và qRT-PCR
|
Điều chỉnh tăng
|
Sàng lọc và tiên lượng
|
|
2
|
miR-25-3p
|
Phân tích microarray và RT-PCR
|
Điều chỉnh tăng
|
Chẩn đoán và điều trị
|
|
3
|
miR-200b
|
Northern blot và qRT-PCR
|
Điều chỉnh tăng
|
Chẩn đoán và điều trị
|
|
4
|
miR-150-5p
|
qRT-PCR
|
Điều chỉnh giảm
|
Tiên lượng
|
|
5
|
miR-6803-5p
|
Phân tích microarray và qRT-PCR
|
Điều chỉnh tăng
|
Chẩn đoán và tiên lượng
|
|
6
|
miR-19a, miR-92a
|
qRT-PCR
|
Điều chỉnh tăng
|
Tiên lượng
|
|
7
|
miR-21-5p, miR-1246, miR-1229-5p, miR-96-5p
|
qRT-PCR
|
Điều chỉnh tăng
|
Theo dõi và điều trị kháng hóa chất
|
Các chữ viết tắt: qRT-PCR (quantitative real-time PCR): PCR định lượng thời gian thực; RT-PCR (reverse transcription PCR): PCR phiên mã ngược.
Giá trị áp dụng của các dấu ấn sinh học trong chẩn đoán ung thư đại trực tràng với độ nhạy, độ đặc hiệu và diện tích dưới đường cong (area under curve: AUC) được tóm tắt ở Bảng 4.
Bảng 4. Giá trị áp dụng của các dấu ấn sinh học trong chẩn đoán ung thư đại trực tràng (Danese E, 2019 [1], Jelski W, 2020 [5], Osumi H, 2020 [7], Xiao Y, 2020 [10])
|
Loại dấu ấn
|
Dấu ấn sinh học
|
Độ nhạy (%)
|
Độ đặc hiệu (%)
|
AUC
|
|
Kháng nguyên ung thư (cancer antigens)
|
Carboembryonic antigen (CEA)
|
64
|
90
|
0,794
|
|
Carbohydrate antigen (CA19-9)
|
34
|
55
|
0,652
|
|
Tissue polypeptide specific antigen (TPS)
|
95
|
83
|
0,802
|
|
Tumor-associated glycoprotein-72 (TAG-72)
|
40
|
77
|
-
|
|
HGFs
|
Stem cell factor (SCF)
|
89
|
17
|
0,723
|
|
Granulocyte-colony stimulating factor (G-SCF)
|
31
|
95
|
0,690
|
|
Macrophage-colony stimulating factor (M-CFS)
|
65
|
95
|
0,830
|
|
Interleukin 6
|
72
|
96
|
0,896
|
|
Interleukin 3
|
55
|
80
|
0,684
|
|
Các enzym (enzymes)
|
Alcohol dehydrogenase (ADH)
|
60
|
70
|
0,654
|
|
Isoenzyme class 1 of ADH
|
76
|
82
|
0,723
|
|
N-acetyl β-D-hexosamindase (HEX) huyết thanh
|
90
|
95
|
0,933
|
|
N-acetyl β-D-hexosamindase (HEX) nước tiểu
|
86
|
81
|
0,874
|
|
Cathepsin D
|
91
|
93
|
0,914
|
|
Ornitine decarboxylase (ODC)
|
82
|
85
|
-
|
|
Các dấu ấn sinh học của sinh thiết lỏng (Biomarkers of liquid biobsy)
|
Circulating tumor cells (CTCs)
|
75
|
100
|
0,91
|
|
Circulating tumor DNA (ctDNA)
|
0,83
|
0,91
|
0,94
|
|
Circulating microRNAs (miRNAs)
miR-29a
miR-29a …
|
62,2
64,9
|
84,7
81,4
|
0,769
0,749
|
|
Exosomal miRNAs
miR-23a
miR-21
Exosomal lncRNAs
Exosomal proteins
CD147(+)
CPNE3
|
-
-
-
-
-
|
-
-
-
-
-
|
0,953
0,798
0,750
0,932
0,791
|
Các chữ viết tắt: granulocyte-colony stimulating factor (G-SCF): yếu tố kích thích dòng bạch cầu hạt ở người, macrophage-colony stimulating factor (M-CFS): yếu tố kích thích dòng đại thực bào ở người, circulating tumor cells (CTCs): các tế bào khối u tuần hoàn, circulating tumor DNA (ctDNA): DNA tuần hoàn, circulating microRNAs (miRNAs): các microRNA tuần hoàn, exosomal miRNAs: các microRNA túi ngoại bào, exosomal long non-coding RNAs (lncRNAs): các RNA không mã hóa chuỗi dài túi ngoại bào, exosomal proteins: các protein túi ngoại bào.
Tóm lại, ung thư đại trực tràng (CRC) có hiệu quả phát hiện thấp và tỷ lệ tử vong cao do không có triệu chứng ở giai đoạn sớm và di căn ở giai đoạn muộn. Ung thư đại trực tràng thường được phát hiện bằng tìm máu trong phân, nội soi đại tràng, đo nồng độ CEA huyết thanh, xét nghiệm DNA trong phân, ... Trong số các phương pháp này, xét nghiệm CEA và nội soi đại tràng là hai phương pháp chủ yếu. Tuy nhiên, CEA bị hạn chế về độ nhạy và độ đặc hiệu, đồng thời nó cũng tăng trong một số ung thư khác. Tiêu chuẩn vàng để sàng lọc ung thư đại trực tràng là nội soi đại tràng, mặc dù nó có độ nhạy cao, nhưng là phương pháp xâm lấn, gây khó chịu cho bệnh nhân, khó lặp lại và độ chính xác phụ thuộc vào trình độ tay nghề của kỹ thuật viên. Trước những thách thức này, một số phương pháp tiếp cận mới như xác định các yếu tố tăng trưởng tạo máu (HGFs), một số enzym như ADH, cathepsin D, … , các dấu ấn sinh học của sinh thiết lỏng như các tế bào khối u tuần hoàn (CTCs), các DNA khối u tuần hoàn (ctDNA), các miRNA khối u tuần hoàn, một số dấu ấn sinh học của các túi ngoại bào như miRNA, lncRNAs và một số protein túi ngoại bào, đã và đang góp phần nâng cao độ chính xác của chẩn đoán, theo dõi và tiên lượng ung thư đại trực tràng.
Tài liệu tham khảo
-
Danese E, Montagnana M, and Lippi G. Circulating molecular biomarkers for screening or early diagnosis of colorectal cancer: which is ready for prime time? Ann Transl Med 2019 Nov; 7(21): 610.
-
Ding Y, Li W, Wang K, Xu C, Hao M, Ding L. Perspectives of the Application of Liquid Biopsy in Colorectal Cancer. BioMed Res Int 2020; 2020(3-4): 1-13.
-
Galvano A, Taverna S, Badalamenti G, et al. Detection of RAS mutations in circulating tumor DNA: a new weapon in an old war against colorectal cancer. A systematic review of literature and meta-analysis. Ther Adv Med Oncol 2019; 11: 1758835919874653.
-
Hauptman N and Glavač D. Colorectal Cancer Blood-Based Biomarkers. Gastroenterol Res Pract 2017; 2017: 2195361.
-
Jelski W, Mroczko B. Biochemical Markers of Colorectal Cancer - Present and Future. Cancer Manag Res 2020; 12: 4789-4797.
-
Lech G, Słotwiński R, Słodkowski M, and Krasnodębski IW. Colorectal cancer tumour markers and biomarkers: Recent therapeutic advances. World J Gastroenterol 2016 Feb 7; 22(5): 1745-1755.
-
Osumi H, Shinozaki E, and Yamaguchi K. Circulating Tumor DNA as a Novel Biomarker Optimizing Chemotherapy for Colorectal Cancer. Cancers (Basel) 2020 Jun; 12(6): 1566.
-
Rapado-González Ó, Álvarez-Castro A, López-López R, et al. Circulating microRNAs as Promising Biomarkers in Colorectal Cancer. Cancers (Basel) 2019 Jul; 11(7): 898-1003.
-
Vacante M, Ciuni R, Basile F, and Biondi A. The Liquid Biopsy in the Management of Colorectal Cancer: An Overview. Biomedicines 2020 Sep; 8(9): 308.
-
Xiao Y, Zhonga J, Zhong B, et al. Exosomes as potential sources of biomarkers in colorectal cancer. Cancer Letters 2020 Apr 28; 476: 13-22.
-
WHO, Globocan. Colorectal cancer. Number of new cases in 2020, both sexes, all ages; Number of deaths in 2020, both sexes, all ages. IARC 2020 Dec: 1-2.
-
WHO, Globocan, Vietnam. Number of new cases in 2020, both sexes, all ages. IARC 2020 Dec: 1-2.


