PGS TS Nguyễn Nghiêm Luật - Bệnh viện Đa khoa MEDLATEC
14/10/2021 | BVĐK MEDLATEC điều trị thành công ung thư gan nguyên phát bằng đốt sóng cao tần 29/08/2021 | Tự ý dừng điều trị viêm gan 2 năm, tái khám phát hiện ung thư gan 22/08/2021 | Giải đáp thắc mắc: Ung thư gan có di truyền không?
Tóm tắt
Ung thư biểu mô đường mật (CCA) thường được phân loại dựa trên vị trí giải phẫu thành các loại phụ CCA trong gan (iCCA) và ngoài gan (eCCA). CCA ngoài gan (eCCA) lại được loại thêm nữa thành ung thư biểu mô đường mật vùng rốn gan (pCCA) và ung thư biểu mô đường mật xa (dCCA). Vị trí giải phẫu của dCCA là đoạn ống mật từ chỗ vào của ống túi mật đến bóng Vater.
1) Các yếu tố nguy cơ: Các yếu tố nguy cơ đã được xác định ở những bệnh nhân bị ung thư biểu mô đường mật xa (dCCA) gồm viêm đường mật xơ cứng nguyên phát (PSC), viêm tụy mạn, u nang đường mật, sỏi đường mật, sán lá gan, hút thuốc lá và béo phì.
2) Các triệu chứng: Các dấu hiệu và triệu chứng ở bệnh nhân ung thư đường mật ở xa (dCCA) có thể gồm vàng da không đau, đau bụng, khó chịu, sụt cân và ngứa.
3) Các dấu ấn sinh học huyết thanh: Với ngưỡng là 37 U/mL, CA 19-9 có độ nhạy là 71% và độ đặc hiệu là 83% để phân biệt bệnh nhân ung thư (dCCA+PDAC) với người không ung thư (Đối chứng+BPD), và có độ nhạy là 77% và độ đặc hiệu là 48% để phân biệt bệnh nhân dCCA với bệnh nhân PDAC. Sự tăng tỷ số CA19-9/GGT (>0,12), di căn bạch huyết và sự biệt hóa khối u là các yếu tố nguy cơ độc lập đối với sự tái phát khối u và sự tiên lượng của dCCA.
4) Các dấu ấn sinh học dựa trên sinh thiết lỏng: Các loại dấu ấn sinh học được phân tích trong máu tuần hoàn hoặc dịch mật của bệnh nhân dCCA có thể gồm: DNA không tế bào (cfDNA), DNA khối u lưu hành (ctDNA), các túi ngoại bào (EVs), các mRNA, protein, cytokine và các chất chuyển hóa khác, và các tế bào khối u tuần hoàn (CTCs). Lợi ích của các dấu ấn sinh học lưu hành mới để chẩn đoán sớm dCCA hiện đang được đánh giá.
5) Các thay đổi về gen và liệu pháp nhắm mục tiêu: Các thay đổi về gen của dCCA bao gồm các đột biến ở các gen ERBB2, ERBB3 (11-14%), KRAS (60%), PI3K-AKT (18%), ELF3 và sự dung hợp ở các gen PRKACA/PRKACB. Phẫu thuật cắt tụy hiện là lựa chọn điều trị hiệu quả và ưu tiên nhất cho dCCA. Gemcitabine cộng với cisplatina là một lựa chọn thích hợp cho điều trị đích ở bệnh nhân dCCA tiến triển.
*
Distal cholangiocarcinoma: value of biomarkers in diagnosis, monitoring and prognosis
Luat Nghiem Nguyen
MEDLATEC General Hospital
Abstract
Cholangiocarcinoma (CCA) is commonly classified based on its anatomical location into the intrahepatic CCA (iCCA) and extrahepatic CCA (eCCA) subtypes. Extrahepatic CCA (eCCA) is further divided into perihilar cholangiocarcinoma (pCCA) and distal cholangiocarcinoma (dCCA). The anatomical location of dCCA is between the cystic duct insertion and the ampulla of Vater.
1) Risk factors: Risk factors have been identified among patients with distal cholangiocarcinoma (dCCA) including primary sclerosing cholangitis (PSC), chronic pancreatitis, choledochal cyst, choledocholithiasis, liver fluke, cigarette smoking, obesity.
2) Symptoms: Signs and symptoms in patients with distal cholangiocarcinoma (dCCA) may include: painless jaundice, abdominal pain, malaise, weight loss, and pruritus.
3) Serum biomarkers: With a cut-off fixed in 37 IU/mL, CA 19-9 showed a sensitivity of 71% and a specificity of 83% to differentiate patients with tumors (dCCA+PDAC) from individuals without tumors (Controls+BPD), and a sensitivity of 77% and a specificity of 48% to differentiate patients with dCCA from those with PDAC. Elevation of CA19-9/GGT (>0.12), lymphatic metastasis and tumor differentiation were independent risk factors for tumor recurrence and long-term prognosis of dCCA.
4) Liquid biopsy based biomarkers: Types of biomarkers can be analyzed in peripheral circulation or in bile of patients with dCCA including: cell-free DNA (cfDNA), circulating tumor DNA (ctDNA), extracellular vesicles (EVs), mRNAs, proteins, cytokines and other serum metabolites, and circulating tumor cells (CTCs). The usefulness of novel circulating biomarkers for early diagnosis of dCCA is being evaluated.
5) The genetic alterations and targeted therapy: The genetic alterations of dCCA include mutations in ERBB2, ERBB3 (11-14%), KRAS (60%), PI3K-AKT (18%), ELF3 genes, and fusions in PRKACA and PRKACB genes. Pancreaticoduodenectomy is currently the most effective and preferred treatment option for dCCA. Gemcitabine plus cisplatina is an appropriate option for the targeted therapy of patients with advanced dCCA.
*
Ung thư biểu mô đường mật (cholangiocarcinoma: CCA) là một khối u ác tính nguyên phát của hệ thống đường mật, bắt nguồn từ các tế bào biểu mô ống mật, là một trong những khối u ác tính hiếm gặp (chỉ chiếm khoảng 3% trong tổng số các khối u ác tính của hệ tiêu hóa) và có tiên lượng kém. Ung thư biểu mô đường mật (CCA) thường được phân loại dựa trên vị trí giải phẫu của nó thành hai loại phụ (subtypes), là ung thư biểu mô đường mật trong gan (intrahepatic CCA: iCCA) và ung thư biểu mô đường mật ngoài gan (extrahepatic CCA: eCCA). Ung thư biểu mô đường mật ngoài gan (eCCA) lại được chia thành ung thư biểu mô đường mật vùng rốn gan (perihilar CCA: pCCA) và ung thư biểu mô đường mật xa (distal CCA: dCCA). Vị trí giải phẫu của dCCA là đoạn ống mật từ chỗ vào của ống túi mật đến bóng Vater, điều này làm cho nó rất gần với tuyến tụy. Ung thư biểu mô đường mật xa (dCCA) chiếm khoảng 20-30%, ung thư biểu mô đường mật vùng rốn gan (dCCA) chiếm khoảng 50%-60%, trong khi ung thư biểu mô đường mật trong gan (iCCA) chỉ chiếm khoảng 10% trong tổng số các ca ung thư biểu mô đường mật (CCA). Mỗi loại phụ của CCA đều có các đặc điểm về dịch tễ học, phân tử và cách điều trị khác nhau [12, 14] (Hình 1).
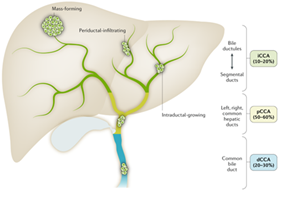
Hình 1: Phân loại theo giải phẫu của các loại ung thư biểu mô đường mật [1].
Tỷ lệ mắc CCA rất khác nhau ở các vùng địa lý khác nhau. Số ca mắc bệnh cao nhất xảy ra ở Đông Nam Á, trong khi số ca thấp nhất xảy ra ở Australia. CCA có thể được chẩn đoán dựa trên các biểu hiện lâm sàng, siêu âm (ultrasonography), chụp cắt lớp vi tính (computed tomography), chụp cộng hưởng từ (magnetic resonance imaging), nội soi mật tụy ngược dòng (endoscopic retrograde cholangiopancreatography), chụp đường mật xuyên da (percutaneous transhepatic cholangiography), siêu âm nội soi (endoscopic ultrasound), chọc hút kim nhỏ (fine-needle aspiration), chụp cắt lớp phát xạ positron (positron emission tomography) và các dấu ấn khối u (tumor markers) [13].
Phần lớn bệnh nhân CCA mới (60% ~ 70%) thường được chẩn đoán ở giai đoạn muộn, không thể phẫu thuật cắt bỏ khối u và chỉ có thể được điều trị bằng liệu pháp giảm nhẹ (palliative therapy), đặc biệt là hóa trị liệu (chemotherapy). Khi tình trạng của bệnh nhân xấu đi sau khi hóa trị liệu đầu tiên, phương pháp được khuyến nghị là chăm sóc hỗ trợ. CCA có độ nhạy thấp với hóa trị liệu và chỉ có một số loại thuốc chống ung thư hiệu quả để điều trị. Phẫu thuật hiện là hiệu quả nhất và lựa chọn điều trị ưu tiên cho CCA. Tuy nhiên, phẫu thuật cắt bỏ chỉ có thể được thực hiện ở khoảng 35% bệnh nhân mắc bệnh ở giai đoạn đầu. Bên cạnh đó, tỷ lệ tái phát sau phẫu thuật cũng cao ở những bệnh nhân được phẫu thuật cắt bỏ khối u CCA. Tính không đồng nhất về sự tăng sinh, về di truyền và những thay đổi vi môi trường khối u có khả năng thúc đẩy sự tiến triển của khối u và cản trở hiệu quả của hóa trị liệu [12].
Trong bài viết này, chúng tôi trình bày tổng quan về các yếu tố nguy cơ, dấu hiệu và triệu chứng, giá trị của các dấu ấn khối u huyết thanh, các dấu ấn sinh học sinh thiết lỏng, các bất thường về gen và điều trị đích của ung thư biểu mô đường mật xa (dCCA).
1. Các yếu tố nguy cơ
Ung thư biểu mô đường mật xa (distal cholangiocarcinoma: dCCA) là một bệnh lý ác tính hiếm gặp, thường có biểu hiện lâm sàng tương tự như ung thư tuyến tụy (pancreatic cancer), tuy nhiên, dCCA có một tập hợp các yếu tố nguy cơ riêng biệt. Các yếu tố nguy cơ đã được xác định ở bệnh nhân bị ung thư biểu mô đường mật xa (dCCA) gồm viêm đường mật xơ cứng nguyên phát (primary sclerosing cholangitis: PSC), viêm tụy mạn (chronic pancreatitis), u nang đường mật (choledochal cyst), sỏi đường mật (choledocholithiasis), sán lá gan (liver fluke), hút thuốc lá và béo phì.
2. Các triệu chứng
Các triệu chứng ở bệnh nhân ung thư đường mật ở xa (dCCA) có thể gồm vàng da không đau (painless jaundice), đau bụng vùng thượng vị, khó chịu, sụt cân và ngứa.
3. Các dấu ấn sinh học huyết thanh
3.1. CA 19-9
Mức độ CA 19-9 huyết thanh ở người khỏe mạnh bình thường là 0-37 U/mL. CA 19-9 là dấu ấn sinh học duy nhất được FDA chấp thuận sử dụng trong PDAC để theo dõi đáp ứng điều trị và để phát hiện tái phát sau phẫu thuật. Tuy nhiên, do độ nhạy và độ đặc hiệu thấp, CA 19-9 không được xem là một dấu ấn sinh học tối ưu để phát hiện sớm PDAC. CA 19-9 huyết thanh cũng được sử dụng trên lâm sàng để giúp chẩn đoán và theo dõi đáp ứng với điều trị trong ung thư biểu mô đường mật (CCA). Ngoài ra, CA 19-9 có thể tăng ở những bệnh nhân bị tắc mật, bệnh gan, bệnh tụy mạn, ... Điều đặc biệt là, sự biểu hiện của CA 19-9 cần phải có sản phẩm gen Lewis là 1,4-fucosyltransferase, loại enzym chỉ được thấy ở những bệnh nhân có nhóm máu Le (a-b+) hoặc Le (a+b-). Khoảng 10% những người Caucasian có kiểu gen Lea-b-, sẽ có kiểu hình Lewis âm tính (Lewis-negative phenotype), cơ thể không sản xuất được CA 19-9 và những người này không thể được sử dụng xét nghiệm CA19-9 để chẩn đoán CCA [12].
Trong một nghiên cứu trên các bệnh nhân ung thư biểu mô đường mật xa (dCCA, n = 34), bệnh nhân ung thư biểu mô ống tụy (pancreatic ductal adenocarcinoma: PDAC, n=38), bệnh đường mật lành tính (benign pancreatic diseases: BPD, n=42) như viêm tụy mạn (chronic pancreatitis) hoặc các nang tụy (pancreatic cysts) và đối chứng (control, n = 25), được chia thành các nhóm phát hiện và nhóm xác thực, với ngưỡng (cut-off) CA19-9 là 37 IU/mL, CA 19-9 cho thấy khả năng chẩn đoán phân biệt tốt giữa những bệnh nhân có khối u (dCCA+PDAC) với những người khỏe mạnh, với AUC là 0,93 trong cả hai nhóm. Tuy nhiên, CA 19-9 là khá tốt để phân biệt giữa những bệnh nhân có khối u dCCA+PDAC và những người không bị ung thư (Đối chứng+BPD) (Hình 2A). AUC có các giá trị lần lượt là 0,845, 0,820 và 0,828 trong việc phát hiện, xác nhận và toàn bộ nhóm (Hình 2B).
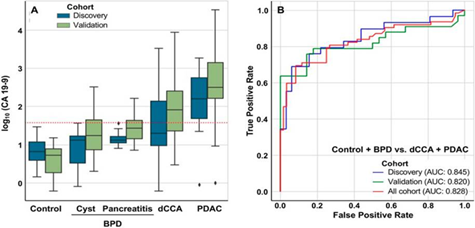
Hình 2. Khả năng dự đoán chẩn đoán của CA 19-9 ở bệnh nhân ung thư (dCCA + PDAC) so với ở người không có khối u (Đối chứng+BPD). (A) Biểu đồ cột cho thấy log10 CA 19-9 (với giá trị cắt là 37 IU/mL); (B) Diện tích dưới đường cong đặc tính hoạt động (AUC) ở nhóm phát hiện, nhóm xác nhận và ở tất cả các nhóm [9].
Một nghiên cứu cho thấy, với ngưỡng (cut-off) CA19-9 là 37 IU/mL, CA 19-9 có độ nhạy 71% và độ đặc hiệu là 83% để chẩn đoán phân biệt bệnh nhân có khối u (dCCA+PDAC) với những người không có khối u (Đối chứng+BPD). Nghiên cứu cũng cho thấy CA 19-9 cho thấy độ nhạy là 77% và độ đặc hiệu là 48% để chẩn đoán phân biệt bệnh nhân dCCA với PDAC [9].
Trong một nghiên cứu gần đây, người ta còn thấy rằng mức độ tăng thrombospondin-2 (THBS2) ở cả dCCA và PDAC là tương tự nhau, và rằng, sự tăng kết hợp của THBS2 và CA 19-9 có giá trị vượt trội hơn chẩn đoán phân biệt dCCA và PDAC với người cho khỏe mạnh so với ở bệnh nhân chỉ tăng CA 19-9 một mình, kể cả trong các giai đoạn sớm của bệnh.
Kháng nguyên ung thư bào thai (carcinoembryonic antigen: CEA) đôi khi cũng có thể được sử dụng trong chẩn đoán CCA. Tuy nhiên, chỉ khoảng 30% bệnh nhân CCA có nồng độ CEA huyết thanh tăng. Hơn nữa, nghiên cứu chỉ ra rằng việc đánh giá mức độ CEA đơn thuần không đủ độ nhạy và độ đặc hiệu cho chẩn đoán CCA.
Ngoài ra, người ta cũng thấy có sự tăng có ý nghĩa của một số dấu ấn sinh học gan như ALT, GGT, phosphatase kiềm (ALP) và bilirubin toàn phần (total bilirrubin) ở những bệnh nhân dCCA và ung thư biểu mô tuyến ống tụy (pancreatic ductal adenocarcinoma: PDAC). Trừ bilirubin toàn phần, các thông số này cũng được thấy tăng trong các bệnh tụy lành tính (benign pancreatic diseases: BPD), mặc dù mức độ thay đổi thấp hơn so với ở bệnh nhân có khối u.
Nồng độ các dấu ấn sinh học huyết thanh ở nhóm đối chứng, các bệnh tụy lành tính (BPD), ung thư biểu mô ống mật xa (dCCA) và ung thư biểu mô tuyến ống tụy (PDAC) được thể hiện ở Bảng 1.
Bảng 1. Nồng độ một số dấu ấn sinh học huyết thanh ở nhóm đối chứng, bệnh tụy lành tính (BPD), ung thư biểu mô tuyến ống mật xa (dCCA) và ung thư biểu mô tuyến ống tụy (PDAC) [9].
|
Dấu ấn sinh học
|
Đối chứng (n=13)
|
Bệnh tụy lành tính (n=20)
|
Ung thư biểu mô đường mật xa (n=18)
|
Ung thư biểu mô ống tụy (n=19)
|
|
CA19-9 (U/mL)
|
8,6 ±7,4
|
15,1 ± 10,5a
|
328 ± 855a,b
|
431 ± 561a,b
|
|
ALT (U/L)
|
17,1 ± 6,7
|
32,0 ± 27,0
|
38,5 ± 94,5
|
208 ± 318a,b
|
|
GGT (U/L)
|
19,0 ± 9,8
|
100 ± 142a
|
411 ± 816a,b
|
784 ± 978a,b
|
|
ALP (U/L)
|
58,5 ± 22,9
|
94 ± 68
|
207 ± 153a
|
380 ± 359a,b
|
|
Total Bil (mg/dL)
|
0,6 ± 0,2
|
0,8 ± 1,7
|
2,8 ± 4,9a
|
7,3 ± 6,2a,b
|
Ghi chú: a, p<0,05 so với đối chứng và b, p<0,05 so với bệnh tụy lành tính (BPD).
Đối với ung thư biểu mô tế bào gan - đường mật kết hợp (combined hepatocellular-cholangiocarcinoma: CHC), giá trị chẩn đoán của CA 19-9 còn chưa rõ ràng. Ung thư biểu mô tế bào gan - đường mật kết hợp (CHC) là một ung thư gan nguyên phát hỗn hợp giữa ung thư biểu mô tế bào gan (HCC) và ung thư biểu mô đường mật (CCA), với cách xử trí và tiên lượng khác nhau. Việc chẩn đoán phân biệt không xâm lấn chính xác trước phẫu thuật ung thư CHC với các ung thư HCC hoặc CCA là rất quan trọng nhưng rất khó khăn do có sự trùng lặp về các đặc điểm lâm sàng và chẩn đoán hình ảnh.
Nồng độ CA 19-9 và AFP huyết thanh tăng cùng với các đặc điểm về chẩn đoán hình ảnh khác nhau có thể gợi ý về CHC. Các tiêu chuẩn chẩn đoán phân biệt CHC với HCC và CCA có sự liên quan đến nồng độ AFP huyết thanh (ngưỡng 20 ng/mL), CA 19-9 (ngưỡng 100 U/mL) và các phát hiện siêu âm tăng cường độ tương phản. Tuy nhiên, CA 19-9 có độ nhạy kém (32,5%) mặc dù có độ đặc hiệu (93,8%), PPV (72,2%) và NPV (73,5%) khá cao. Do đó, để chẩn đoán phân biệt dCCA với CHC và HCC, ngoài CA19-9, AFP, cần kết hợp thêm các phương pháp chẩn đoán hình ảnh khác nhau [8].
3.2. Tỷ số CA19-9/GGT
Có sự liên quan chặt chẽ giữa nồng độ CA19-9 huyết thanh với sự chẩn đoán, tái phát và tiên lượng khối u ác tính. Nhiều loại tế bào khối u có khả năng tổng hợp CA19-9 như các tế bào biểu mô tuyến tụy, ống mật, dạ dày, ruột kết, … Khi tắc mật, CA19-9 có nguồn gốc từ tế bào biểu mô ống mật không thể bài tiết vào đường ruột một cách bình thường và CA19-9 từ tế bào biểu mô tụy có thể chảy ngược vào đường mật một cách bất thường. Sự viêm cục bộ thứ phát sau tắc mật cũng dẫn đến sự tăng sinh của các tế bào biểu mô ống mật. Những điều này sẽ gây ra sự tăng bất thường của nồng độ CA19-9 huyết thanh. Trong trường hợp không có các triệu chứng cụ thể, hầu hết bệnh nhân dCCA không được chẩn đoán và điều trị cho đến khi họ có triệu chứng vàng da. Khi tắc mật xảy ra, nồng độ CA19-9 sẽ không phù hợp với sự gia tăng xâm lấn của khối u, làm giá trị tiên lượng của CA19-9 đối với dCCA giảm đi. Vì vậy, giá trị của tỷ số CA19-9/GGT (trong đó GGT là một enzym được cảm ứng khi tắc mật) trong tiên lượng tái phát và thời gian sống sót trong dCCA đã được đánh giá [5].
Gamma-Glutamyltransferase (γ-Glutamyltransferase: GGT) là một enzym phân bố rộng rãi trong cơ thể người và nằm trên bề mặt của màng tế bào và là một enzym quan trọng tham gia vào quá trình chuyển hóa glutathione (GSH). GGT tham gia vào quá trình oxy hóa và đóng vai trò tiền viêm, dẫn đến sự xuất hiện của các bệnh chuyển hóa mạn tính khác nhau và có liên quan chặt chẽ đến sự xuất hiện và phát triển của các khối u. GGT huyết thanh chủ yếu được tiết ra từ hệ thống gan mật và được bài tiết qua mật. Sau khi tắc mật dẫn đến tắc nghẽn dẫn lưu mật, GGT do tế bào biểu mô ống mật và tế bào gan sản xuất tăng lên và do tắc nghẽn bài tiết mật, GGT đi vào máu theo dòng chảy ngược lại và có thể làm tăng GGT trong huyết tương. Tuy nhiên, GGT thường được sử dụng trên lâm sàng như một xét nghiệm chẩn đoán, chủ yếu là dấu ấn sinh học của bệnh gan mật và nghiện rượu rượu. Mặc dù GGT được bài tiết ở nhiều loại khối u, vai trò của nó trong hoạt động và tiên lượng khối u ác tính vẫn chưa rõ ràng [5].
Các dữ liệu trước phẫu thuật gồm giới tính, độ tuổi, tiền sử hút thuốc lá, đái tháo đường, các bệnh tụy lành tính (BPD), bilirubin toàn phần (Total Bil), GGT, CA19-9, CA19-9/GGT, đã được Jiang T và cộng sự, 2021 [5] sử dụng để phân tích đơn biến và đa biến nhằm đánh giá tiên lượng nguy cơ tái phát khối u dCCA và tiên lượng thời gian sống sót sau phẫu thuật. Khi phân tích đơn biến về nguy cơ tái phát và sự sống sót sau phẫu thuật ở các bệnh nhân ung thư biểu mô đường mật xa (dCCA), các tác giả thấy rằng nồng độ CA19-9 huyết thanh tăng, tỷ số CA19-9/GGT tăng, mức độ biệt hóa và di căn hạch là các yếu tố nguy cơ độc lập đối với sự tái phát dCCA và thời gian sống sót sau phẫu thuật, trong khi nồng độ GGT huyết thanh và kích thước khối u không phải là yếu tố nguy cơ đối với sự tái phát và sự sống sót sau phẫu thuật (Bảng 2).
Bảng 2. Phân tích đơn biến về nguy cơ tái phát (%) và sự sống sót sau phẫu thuật (%) ở các bệnh nhân ung thư biểu mô đường mật xa [5].
|
Thông số
|
n
|
Nguy cơ tái phát (%)
|
Sự sống sót (%)
|
|
Sau 1 năm (%)
|
Sau 3 năm (%)
|
P
|
Sau 1 năm (%)
|
Sau 3 năm (%)
|
P
|
|
CA19-9 (U/mL)
|
≤37
|
69
|
83,5
|
43,7
|
|
85
|
49
|
|
|
>37
|
117
|
56,5
|
28
|
0,017
|
65,5
|
25,5
|
0,004
|
|
GGT (U/L)
|
≤45
|
11
|
51,1
|
51,1
|
|
71,6
|
43
|
|
|
>45
|
175
|
68
|
34
|
0,506
|
72,9
|
34,1
|
0,681
|
|
CA19-9/GGT
|
≤0,12
|
81
|
84,2
|
51
|
|
88,3
|
59,2
|
|
|
>0,12
|
105
|
52,9
|
20,1
|
0
|
61
|
13,6
|
0
|
|
Mức độ biệt hóa
|
Nghèo
|
52
|
34,2
|
22,2
|
|
51,5
|
19,4
|
|
|
TB và cao
|
134
|
79,9
|
39
|
0
|
80,9
|
40
|
0
|
|
Kích thước khối u (cm)
|
≤2
|
114
|
72,7
|
39,6
|
|
78,4
|
35,7
|
|
|
>2
|
72
|
57,7
|
24,5
|
0,069
|
63,6
|
31,3
|
0,214
|
|
Di căn hạch bạch huyết
|
Có
|
75
|
45,6
|
15,4
|
|
59,8
|
15,8
|
|
|
Không
|
111
|
51,1
|
47,8
|
0
|
81,4
|
48,4
|
0
|
Khi phân tích đa biến về nguy cơ tái phát và sự sống sót sau phẫu thuật ở các bệnh nhân ung thư biểu mô đường mật xa (dCCA), người ta thấy rằng chỉ còn tỷ số CA19-9/GGT tăng, mức độ biệt hóa của khối u và sự di căn hạch là các yếu tố nguy cơ độc lập đối với sự tái phát dCCA và thời gian sống sót sau phẫu thuật [5, 16], trong khi nồng độ CA19-9 huyết thanh, nồng độ GGT huyết thanh và cả kích thước khối u không còn là yếu tố nguy cơ đối với sự tái phát dCCA sau phẫu thuật [5] (Bảng 3).
Bảng 3. Phân tích đa biến về nguy cơ tái phát và sự sống sót sau phẫu thuật ở các bệnh nhân ung thư biểu mô đường mật xa [5].
|
Thông số
|
Nguy cơ tái phát (RR)
|
Sự sống sót (RR)
|
|
RR
|
95%CI
|
P
|
RR
|
95%CI
|
P
|
|
CA19-9
|
0,921
|
0,578-1,468
|
0,728
|
0,974
|
0,607-1,561
|
0,911
|
|
CA19-9/GGT
|
2,134
|
1,319-3,451
|
0,002
|
2,837
|
1,727-4,660
|
0
|
|
Mức độ biệt hóa
|
1,695
|
1,115-2,576
|
0,013
|
1,725
|
1,140-2,609
|
0,01
|
|
Di căn hạch lympho
|
2,145
|
1,404-3,277
|
0
|
2,05
|
1,336-3,144
|
0,001
|
Ghi chú: RR (relative risk): Nguy cơ tương đối; 95%CI (95% confidence interval): khoảng tin cậy 95%.
4. Các dấu ấn sinh học của sinh thiết lỏng của dCCA
Phẫu thuật cắt bỏ là phương pháp điều trị tiềm năng duy nhất đối với CCA, tuy nhiên, phần lớn bệnh nhân được chẩn đoán CCA đã ở giai đoạn nặng nên không thể điều trị phẫu thuật. Vì vậy, sinh thiết lỏng (liquid biobsy: LB) có tiềm năng hấp dẫn để tăng cơ hội được chẩn đoán ở giai đoạn sớm hơn, khắc phục những khó khăn và nguy cơ của việc sinh thiết mô để chẩn đoán sớm CCA. Ngoài ra, sinh thiết lỏng (LB) còn có thể cung cấp khả năng đánh giá tính không đồng nhất của khối u, xác định các dấu sinh học khối u đích, đánh giá đáp ứng điều trị và cơ chế kháng với hóa trị liệu.
Thuật ngữ “sinh thiết lỏng” (LB) bao gồm một nhóm các phương pháp khác nhau, tập trung vào việc phát hiện các dấu ấn sinh học khối u từ các mẫu chất lỏng. Máu, huyết tương, dịch mật, nước tiểu hoặc các chất lỏng khác được tiếp cận theo phương pháp LB xâm lấn tối thiểu có thể được sử dụng một cách nối tiếp để giải thích về sinh bệnh học.
Một số kỹ thuật mới có thể được áp dụng để phân tích mẫu, như giải trình tự thế hệ tiếp theo (next generation sequencing: NGS) cho độ nhạy cao và giới hạn phát hiện thấp hơn, cho phép phát hiện ngay cả những lượng rất nhỏ vật liệu di truyền có nguồn gốc từ khối u. Độ nhạy của giải trình tự NGS rất cao so với giải trình tự Sanger truyền thống, cho phép phát hiện nhiều kiểu thay đổi di truyền bao gồm các đa hình đơn nucleotide, các đột biến điểm, đột biến chèn và đột biến xóa với độ chính xác cao (với độ nhạy và độ đặc hiệu khoảng 95% -100%), làm tăng khả năng phát hiện các đột biến trong các ung thư và các bệnh khác.
So với phương pháp sinh thiết mô truyền thống, sinh thiết lỏng ít xâm lấn hơn và có thể lặp lại, cho phép theo dõi thời gian thực về quá trình tiến triển của khối u hoặc đáp ứng điều trị [11].
4.1. DNA không tế bào và DNA khối u tuần hoàn (cfDNA/ctDNA)
Các DNA không tế bào (cell-free DNA: cfDNA) và DNA khối u tuần hoàn (circulating tumor DNA: ctDNA) có thể được giải phóng từ các tế bào khối u vào vòng tuần hoàn qua quá trình bài tiết của sự chuyển hóa, của sự chết tế bào theo chương trình (apoptosis) hoặc của sự hoại tử (necrosis).
Sự ra đời của kỹ thuật giải trình tự thế hệ tiếp theo (NGS) đối với cfDNA/ctDNA gần đây đã giúp phát hiện các thay đổi di truyền và biểu sinh liên quan đến CCA, do đó đã mở rộng giá trị chẩn đoán và điều trị tiềm năng của sinh thiết lỏng. Người ta thấy có sự phù hợp cao (90,3%) giữa các đột biến như KRAS, NRAS, BRAF và PIK3CA ở DNA từ sinh thiết khối u và cfDNA từ sinh thiết lỏng huyết tương ở bệnh nhân CCA.
Một vai trò khác của ctDNA/cfDNA là có thể được sử dụng để theo dõi đáp ứng với hóa trị liệu và điều trị đích.
Ngoài việc sử dụng huyết tương làm nguồn ctDNA/cfDNA, việc sử dụng dịch mật cũng cho kết quả đầy hứa hẹn trong chẩn đoán CCA. Sự phân tích DNA không tế bào (cfDNA) trong dịch mật từ sinh thiết lỏng và DNA khối u từ sinh thiết mô đều cho phép phát hiện các thay đổi ở DNA, như các đột biến chèn và xóa nucleotide đơn với độ nhạy và độ đặc hiệu cao, tương ứng với 94,7% và 99,9% [11].
Nghiên cứu cũng cho thấy DNA không tế bào (cfDNA) trong sinh thiết lỏng từ dịch mật hoạt động tốt hơn cfDNA từ huyết tương trong việc phát hiện đột biến soma ở bệnh nhân CCA. DNA không tế bào (cfDNA) từ dịch mật có thể là một sinh thiết lỏng đáng tin cậy trong chẩn đoán CCA và có thể là một công cụ bổ sung khả thi để xác nhận chẩn đoán CCA [4].
4.2. Các túi nội bào (EVs) và miRNA
Các túi nội bào (extracellular vesicles: EVs) và các miRNA đã nhận được sự quan tâm đặc biệt do tính ổn định và sự phong phú của chúng trong các dịch sinh học. Các nghiên cứu gần đây đã chứng minh rằng các túi nội bào (EVs) trong dịch mật chứa các lượng miRNA đáng kể.
Các RNA nhỏ, không mã hóa (small, noncoding RNAs: sncRNA, 18-25 nucleotide) đóng vai trò quan trọng trong việc điều hòa một số quá trình sinh học thiết yếu và rất quan trọng đối với sự phát triển của các loại ung thư khác nhau. Một số miRNA bị mất điều hòa (deregulated miRNAs) đã được công nhận là có chức năng như những chất gây ung thư (oncogenic) hoặc những chất ức chế khối u (tumor suppressors). Một trong những miRNA được mô tả rộng rãi nhất trong CCA là miR-21, một miRNA gây ung thư có sự biểu hiện quá mức tương quan với giai đoạn khối u và khả năng sống sót kém.
Một nghiên cứu gần đây cho thấy hai miRNA gồm miR-16 điều chỉnh giảm và miR-877 điều chỉnh tăng có giá trị chẩn đoán phân biệt ung thư biểu mô đường mật xa (dCCA) với các bệnh tụy lành tính (BPD, AUC=0,90) và với ung thư biểu mô ống tụy (PDAC, AUC=0,88) [9].
Các nghiên cứu sinh thiết lỏng trên dịch mật cũng cho thấy mật là dịch sinh học cho khả năng chẩn đoán CCA cao nhất, sau đó là huyết thanh, mô và nước tiểu, với độ chính xác (AUC) lần lượt là 0,95, 0,913, 0,846 và 0,745 [11].
Một số nghiên cứu đã cho thấy các miRNA có tiềm năng là dấu ấn sinh học chẩn đoán và tiên lượng (diagnostic and prognostic biomarkers) đối với CCA, tuy nhiên, hiện còn thiếu bằng chứng mạnh về nguồn gốc của các mi-RNA và về việc phân nhóm nào có thể cung cấp các thông tin đáng tin cậy nhất để áp dụng trong thực hành lâm sàng [11].
4.3. Các protein, cytokine và các chất chuyển hóa khác
Các protein, cytokine và các chất chuyển hóa khác trong huyết thanh gần đây đã được đánh giá là các dấu ấn sinh học chẩn đoán và tiên lượng tiềm năng cho CCA. Nồng độ tăng của cytokeratin-19 (CYFRA 21-1), MMP-7, osteopontin, periostin và IL-6 đã được thấy trong huyết thanh của bệnh nhân bị CCA, khác với ở những người khỏe mạnh và ở những bệnh nhân bị các bệnh đường mật lành tính (benign biliary diseases).
Trong số các dấu ấn sinh học trên, CYFRA 21-1 có giá trị chẩn đoán tốt nhất, phù hợp cao với tình trạng lâm sàng của bệnh nhân CCA và có sự giảm sau phẫu thuật cắt bỏ và tăng khi khối u tái phát. CYFRA 21-1 cũng thể hiện là một yếu tố dự đoán độc lập về khả năng sống sót sau 1 năm không tái phát và tỷ lệ sống sót tổng thể trên phân tích đa biến.
Nồng độ osteopontin huyết thanh cũng tăng rõ rệt ở bệnh nhân CCA so với nhóm đối chứng khỏe mạnh và với bệnh nhân viêm xơ đường mật nguyên phát (primary sclerosing cholangitis: PSC), trong khi nồng độ osteopontin huyết thanh trước và sau phẫu thuật cũng có sự tương quan với thời gian sống sót của bệnh nhân [11].
4.4. Các tế bào khối u tuần hoàn (CTCs)
Mặc dù mới chỉ có một số nghiên cứu đề cập đến vai trò tiềm năng của các tế bào khối u tuần hoàn (CTCs) như là dấu ấn sinh học chẩn đoán và tiên lượng trong CCA, một số nghiên cứu gần đây đã công nhận có sự liên quan giữa số lượng CTCs và thời gian sống của bệnh nhân ở bệnh nhân ung thư biểu mô đường mật. Sau khi phân tích sự hiện diện của các tế bào khối u tuần hoàn (CTCs) ở 88 bệnh nhân CCA, người ta thấy rằng số lượng các CTCs ≥5 có liên quan đến mức độ khối u và đặc điểm khối u ác tính hơn, cũng như dự đoán độc lập về thời gian sống sót ngắn hơn. Tỷ lệ nguy nguy cơ HR (Hazard Ratio) của số lượng CTCs ≥2 là 2,5 (CI 95%=1,1-5,4; P=0,02 và HR của số lượng CTCs ≥5 là 4,1 (CI 95% =1,4-10,8; P=0,01) [11].
Tiềm năng ứng dụng của các dấu ấn sinh học của sinh thiết lỏng trong máu tuần hoàn hoặc trong mật (DNA tuần hoàn, RNA tuần hoàn, các exosom, cytokine) trong chẩn đoán, theo dõi và tiên lượng ung thư đường mật được thể hiện ở Bảng 3.
Bảng 3. Tiềm năng ứng dụng của các dấu ấn sinh học của sinh thiết lỏng trong chẩn đoán và tiên lượng ung thư biểu mô đường mật [11].
|
Các dấu ấn sinh học sinh thiết lỏng
|
Sự thay đổi
|
Nguồn
|
Tiềm năng ứng dụng
|
|
DNA
ARID1A, BAP1, BLC2, BRAF, CDKN2A, FBXW7, FGFR2, IDHA1, IDH2, KRAS, NRAS, PBRM1, PIK3CA, SMAD4, TP53
|
Các đột biến
|
Huyết thanh
|
Có giá trị chẩn đoán
|
|
ERBB2
|
Khuếch đại
|
Huyết thanh
|
Có giá trị chẩn đoán
|
|
FGFR2
|
Dung hợp (fusions)
|
Huyết thanh
|
Có giá trị chẩn đoán và tiên lượng
|
|
microRNA
miR-9, miR-21, miR-29b, miR-106, miR-122, miR-150, miR-155, miR-192, miR-200 family
|
Sự thể hiện ↑
|
Huyết thanh
|
Có giá trị chẩn đoán và tiên lượng
|
|
miR-26a, miR-26a-5p, miR-30b, miR-126, miR-141-3p, miR-551B, miR-604, miR-1281, miR-96-5p, miR-151a-5p, miR-191-5p, miR-4732-3p
|
|
Huyết thanh
|
Có giá trị chẩn đoán
|
|
miR-30d-5p, miR-92a-3p, miR-412, miR-640, miR-1537, miR-3189, miR-191, miR-486-3p, miR-1274b, miR-16 and miR-484
|
|
Mật
|
Có giá trị chẩn đoán
|
|
Các protein và cytokine
Cytokeratin-19, MMP-1, MMP-7, MMP-9, MMP-10, Periostin, IL-6, CYFRA 21-1, Osteopontin
|
Sự thể hiện ↑
|
Huyết thanh
|
Có giá trị chẩn đoán và tiên lượng
|
|
Các chất chuyển hóa
Glycine, aspartic acid, SM (42:3), and SM (43:2)
|
Sự thể hiện ↑
|
Huyết thanh
|
Có giá trị chẩn đoán và tiên lượng
|
Như vậy, sinh thiết lỏng, với sự xâm lấn tối thiểu, có thể đóng vai trò là các dấu ấn sinh học trong sàng lọc, chẩn đoán, theo dõi điều trị, dự đoán tái phát và tiên lượng bệnh nhân dCCA. Vai trò của sinh thiết lỏng trong thực hành lâm sàng của bệnh nhân dCCA còn rất nhỏ và cần được nghiên cứu thêm để đánh giá tiềm năng của nó và hướng tới phương pháp tiếp cận y học chính xác và đa phương thức.
5. Các bất thường phân tử và điều trị đích trong dCCA
5.1. Các bất thường phân tử trong dCCA
Các bất thường phân tử xuất hiện trong các kiểu phụ (anatomic subtypes) về giải phẫu của ung thư biểu mô đường mật được thể hiện ở hình 2. Các bất thường về phân tử (đột biến) trong ung thư biểu mô đường mật xa gồm các đột biến trên các gen:
1) Các đột biến trên các gen ERBB2 và ERBB3: Các đột biến trên các gen ERBB2 và ERBB3 chiếm 11-14% trong tổng số các đột biến gen ở các bệnh nhân dCCA.
2) Các đột biến trên gen KRAS: Các đột biến trên gen KRAS chiếm 60% trong tổng số các đột biến gen ở các các bệnh nhân dCCA.
3) Các đột biến trên gen PI3K-AKT: Các đột biến trên các gen PI3K-AKT chiếm 18% trong tổng số các đột biến gen ở các bệnh nhân dCCA [10].
4) Các đột biến trên gen ELF3.
5) Sự dung hợp ở các gen PRKACA và PRKACB [2].
Các bất thường phân tử xuất hiện trong các kiểu phụ (anatomic subtypes) về giải phẫu của ung thư biểu mô đường mật [10] được thể hiện ở Hình 3.
![Các loại bất thường phân tử xuất hiện trong các kiểu phụ về giải phẫu của ung thư biểu mô đường mật [10]. Molecular abrretion: những bất thường phân tử; frequency: tần suất.](https://login.medlatec.vn//ckfinder/userfiles/images/ung-thu-bieu-mo-duong-mat-1.jpg)
Hình 3. Các loại bất thường phân tử xuất hiện trong các kiểu phụ về giải phẫu của ung thư biểu mô đường mật [10]. Molecular abrretion: những bất thường phân tử; frequency: tần suất.
5.2. Điều trị đích ung thư biểu mô đường mật xa (dCCA):
Ung thư biểu mô đường mật xa (dCCA) và ung thư biểu mô tuyến tụy (pancreatic ductal adenocarcinoma: PDAC) là những thực thể riêng biệt. Ung thư đường mật xa có tiên lượng thuận lợi so với ung thư biểu mô tuyến tụy, tuy nhiên, các phác đồ điều trị bổ trợ hiện tại chỉ liên quan đến việc cải thiện tỷ lệ sống sót trong PDAC chứ không phải dCCA. Do đó, các mô hình điều trị được sử dụng cho PDAC không nên ngoại suy cho dCCA, mặc dù các phương pháp điều trị tương tự và các liệu pháp mới cho dCCA nên được khám phá [3].
5.2.1. Điều trị đích ở bệnh nhân dCCA có các đột biến ERBB2/ERBB3
Hiện nay, việc điều trị đích ở bệnh nhân dCCA có các đột biến ERBB2/ERBB3 đang được thử nghiệm lâm sàng. Hai loại liệu pháp (thuốc) nhắm đích chính chống lại các gen thay đổi của họ thụ thể yếu tố tăng trưởng biểu bì ERBB (anti-epidermal growth factor receptor family: anti-ERBB therapies) được sử dụng trong điều trị đích ung thư là các kháng thể đơn dòng (monoclonal antibodies), có tác dụng ngăn chặn sự gắn phối tử (blocking ligand binding) và các chất ức chế tyrosine kinase (tyrosine kinase inhibitors: TKI), nhắm đích vào vùng xúc tác (catalytic domain) của thụ thể này. Những thay đổi về gen của họ thụ thể yếu tố tăng trưởng biểu bì (ERBB) đã được báo cáo ở ung thư túi mật (19%), ở ung thư biểu mô đường mật vùng rốn gan và ung thư biểu mô đường mật xa (pCCA/dCCA) (17%), và ở ung thư biểu mô đường mật trong gan (iCCA) (4,8%).
Trong khi vai trò sinh lý bệnh của ERBB3 và ERBB4 trong ung thư biểu mô đường mật (CCA) vẫn còn chưa được rõ thì vai trò sinh khối u (tumorigenic role) của EGFR và ERBB2 (HER2) trong CCA, được trung gian bằng việc kích hoạt các con đường tín hiệu MAPK-ERK hoặc PI3K-mTOR đã được một số nghiên cứu mô tả. Các chất ức chế EGFR khác nhau đã được thử nghiệm trong CCA dưới dạng đơn chất hoặc kết hợp, hầu hết ở các khối u kiểu hoang dã có các đột biến trên gen KRAS.
Thuốc ức chế phân tử nhỏ Erlotinib một mình, hoặc kết hợp với cetuximab, cho thấy hoạt tính lâm sàng trên các bệnh nhân dCCA có các đột biến gen ERBB2 và ERBB3, KRAS và PI3K-AKT còn hạn chế.
Kháng thể đơn dòng panitumumab, kết hợp với gemcitabine và irinotecan, cho kết quả hứa hẹn. Tuy nhiên, trong một thử nghiệm pha II, kháng thể đơn dòng panitumumab kết hợp với oxaliplatin và gemcitabine không cho thấy bất kỳ ưu điểm nào so với gemcitabine và cisplatin đơn thuần [10].
5.2.2. Điều trị đích các đột biến ở các gen KRAS, PI3K-AKT, ELF3 hoặc sự dung hợp ở các gen PRKACA và PRKACB
Việc điều trị đích ở bệnh nhân dCCA có đột biến trên các gen PI3K-AKT, KRAS, PI3K-AKT, ELF3 hoặc sự dung hợp ở các gen PRKACA và PRKACB hiện đang được nghiên cứu thử nghiệm lâm sàng [2,10, 15].
Một số nghiên cứu gần đây nhất cho thấy hóa trị bổ trợ thường quy sau khi cắt bỏ dCCA có liên quan đến lợi ích sống sót ở những bệnh nhân dương tính với hạch bạch huyết và dương tính với bờ vết cắt của dCCA (node-positive and margin positive resection) [6, 7].
Kết luận
Ung thư biểu mô đường mật (CCA) có thể được phân loại theo vị trí giải phẫu thành CCA trong gan (iCCA) và ngoài gan (eCCA), CCA ngoài gan lại có thể được phân chia thành CCA vùng rốn gan (pCCA) và CCA xa (dCCA). CCA xa là ung thư nằm trên đoạn ống mật từ chỗ phân nhánh ống mật đến bóng Vater. Các yếu tố nguy cơ dCCA gồm viêm đường mật xơ cứng nguyên phát (PSC), viêm tụy mạn, u nang đường mật, sỏi đường mật, sán lá gan, hút thuốc lá và béo phì. Các triệu chứng của dCCA có thể gồm vàng da không đau, đau bụng, khó chịu, sụt cân và ngứa. Với ngưỡng 37 U/mL, CA 19-9 có độ nhạy 71% và độ đặc hiệu 83% để chẩn đoán phân biệt ung thư (dCCA+PDAC) với không ung thư (Đối chứng+BPD), và có độ nhạy 77% và độ đặc hiệu 48% để chẩn đoán phân biệt dCCA với PDAC. Sự tăng tỷ số CA19-9/GGT (>0,12), di căn hạch và sự biệt hóa khối u là các yếu tố nguy cơ đối với sự tái phát và tiên lượng dCCA. Các dấu ấn sinh học dựa trên sinh thiết lỏng ở bệnh nhân dCCA có thể gồm: DNA không tế bào (cfDNA), DNA khối u lưu hành (ctDNA), các túi ngoại bào (EVs), các miRNA, protein, cytokine, các chất chuyển hóa khác và các tế bào khối u tuần hoàn (CTCs). Các thay đổi về gen của dCCA gồm các đột biến ở các gen ERBB2, ERBB3, KRAS, PI3K-AKT, ELF3 và sự dung hợp ở các gen PRKACA và PRKACB. Gemcitabine kết hợp với cisplatina có thể là một lựa chọn thích hợp cho điều trị đích ở bệnh nhân dCCA tiến triển.
Tài liệu tham khảo
1. Banales JM, Marin JJG, Lamarca A, et al. Cholangiocarcinoma 2020: the next horizon in mechanisms and management. Nat Rev Gastroenterol Hepatol 2020 Sep; 17(9): 557-588.
2. Brindley PJ, Bachini M, Ilyas SI, et al. Cholangiocarcinoma. Nat Rev Dis Primers 2021 Sep 9; 7(1): 65.
3. Ethun CG, Lopez-Aguiar AG, Pawlik TM, et al. Distal Cholangiocarcinoma and Pancreas Adenocarcinoma: Are They Really the Same Disease? A 13-Institution Study from the US Extrahepatic Biliary Malignancy Consortium and the Central Pancreas Consortium. J Am Coll Surg 2017 Apr; 224(4): 406-413.
4. Gou Q, C.Z.Zhang CZ, Sun ZH, et al. Cell-free DNA from bile outperformed plasma as a potential alternative to tissue biopsy in biliary tract cancer. ESMO Open 2021 Dec; 6(6): in press.
5. Jiang T, Lyu SC, Zhou L, Wang J, Li H, He Q, Lang R. Carbohydrate antigen 19-9 as a novel prognostic biomarker in distal cholangiocarcinoma. World J Gastrointest Surg 2021; 13(9): 1025-1038.
6. Kamarajah S, Frankel T, Bednar F, Cho C, Nathan H. Adjuvant Therapy in Distal Cholangiocarcinoma Following Pancreaticoduodenectomy: A National Cancer Database Analysis. 2021; 23(S11): in press.
7. Kim BH, Kim K, Chie EK, et al. Long-Term Outcome of Distal Cholangiocarcinoma after Pancreaticoduodenectomy Followed by Adjuvant Chemoradiotherapy: A 15-Year Experience in a Single Institution. Cancer Res Treat 2017 Apr; 49(2): 473-483.
8. Lee T, Teng TZJ, and Shelat VG. Carbohydrate antigen 19-9 - tumor marker: Past, present, and future. World J Gastrointest Surg 2020 Dec 27; 12(12): 468-490.
9. Macias RIR, Muñoz-Bellvís L, Sánchez-Martín A, et al. A Novel Serum Metabolomic Profile for the Differential Diagnosis of Distal Cholangiocarcinoma and Pancreatic Ductal Adenocarcinoma. Cancers (Basel) 2020 Jun; 12(6): 1433.
10. Massironi S, Pilla L, Elvevi A, et al. New and Emerging Systemic Therapeutic Options for Advanced Cholangiocarcinoma. Cells 2020 Mar 11; 9(3): 688.
11. Rompianesi G, Martino MD, Gordon-Weeks A, Montalti R, and Troisi R. Liquid biopsy in cholangiocarcinoma: Current status and future perspectives. World J Gastrointest Oncol 2021 May 15; 13(5): 332-350.
12. Wang M, Chen Z, Guo P, Wang Y, Chen G. Therapy for advanced cholangiocarcinoma: Current knowledge and future potential. J Cell Mol Med 2021 Jan; 25(2): 618-628.
13. Wang B, Chen L and Chang HT. Potential diagnostic and prognostic biomarkers for cholangiocarcinoma in serum and bile. Biomark Med 2016 Jun; 10(6): 613-619.
14. Waseem D and Tushar P. Intrahepatic, perihilar and distal cholangiocarcinoma: Management and outcomes. Ann Hepatol 2017 Jan-Feb 2017; 16(1): 133-139.
15. Yang W and Sun Y. Promising Molecular Targets for the Targeted Therapy of Biliary Tract Cancers: An Overview. J OncoTargets and Therapy 2021; 14: 1341-1366.
16. Zhou W, Qian L, Rong Y, et al. Prognostic factors and patterns of recurrence after curative resection for patients with distal cholangiocarcinoma. Radiother Oncol 2020 Jun; 147: 111-117.


