Cholesterol là chất sáp trong chất béo ở máu. Mặc dù cholesterol rất quan trọng cho việc hình thành màng tế bào, vitamin D, axit mật và một số hormone, nhưng cholesterol cao có thể làm tăng nguy cơ mắc bệnh tim mạch.
LDL-C nhỏ, đậm đặc (sdLDL-C): một yếu tố dự đoán bệnh tim mạch mạnh hơn LDL-C
PGS TS Nguyễn Nghiêm Luật
Bệnh viện Đa khoa MEDLATEC
Tóm tắt
1. Cholesterol lipoprotein tỷ trọng thấp (LDL-C) là một yếu tố nguy cơ quan trọng cho sự phát triển của bệnh xơ vữa động mạch. Tuy nhiên, nhiều người có mức LDL-C huyết tương bình thường vẫn phát triển bệnh tim mạch. Vậy, yếu tố gây xơ vữa là gì?
2. LDL nhỏ, đậm đặc (sdLDL) là một phân nhóm của LDL. sdLDL nhỏ hơn nhưng nặng hơn LDL-C lớn, nổi (lfLDL) và là một yếu tố gây xơ vữa mạnh vì nó đủ nhỏ để xuyên qua thành động mạch, có ái lực gắn với các thụ thể LDL thấp hơn, có thời gian bán hủy trong máu dài hơn và dễ bị oxy hóa hơn.
3. Khoảng tham chiếu của các mức sdLDL-C đã được xác định là <30 mg/ dL (0,78 mmol/L). Nồng độ SdLDL-C tăng có liên quan đến triglyceride tăng và HDL-C thấp.
4. Những bệnh nhân có sdLDL-C chiếm ưu thế có nguy cơ nhồi máu cơ tim (MI) tăng gấp ba lần, trong khi nguy cơ tương đối là 4,5 đối với bệnh động mạch vành và là 7 đối với MI khi nồng độ sdLDL-C lớn hơn 2,5 mmol/ L (100 mg/ dL). Nồng độ SdLDL-C tăng cũng liên quan đến tăng nguy cơ mắc đái tháo đường loại 2, tiền đái tháo đường, béo phì, hội chứng chuyển hóa (MetS), kháng insulin, rối loạn chức năng thận, gan nhiễm mỡ và acid béo dạng trans trong chế độ ăn.
5. Có thể làm giảm sdLDL-C bằng cách sử dụng các thuốc fibrate, statin, kết hợp fibrate và statin, niacin, …, ăn chế độ ăn giàu chất xơ hòa tan, ít carbohydrate tinh chế, ít acid béo bão hòa, ít acid béo dạng trans và cholesterol, tập thể dục thường xuyên, kiểm soát tốt đường huyết và thực hiện giảm cân.
Small dense LDL-C (sdLDL-C): a stronger predictor of cardiovascular disease than LDL-C
Luat Nghiem Nguyen
MEDLATEC General Hospital
Abstract
1. Low-density lipoprotein cholesterol (LDL-C) plays a key role in the development and progression of atherosclerosis and cardiovascular disease. However, many individuals with LDL-C within the normal range still develop cardiovascular disease. So, what is the atherogenic factor?
2. Small dense LDL (sdLDL) is a subtype of LDL. It is smaller and heavier than large floating LDL (lfLDL) and is an extremely atherogenic factor because it is small enough to penetrate the walls of arteries, have a lower binding affinity for LDL receptors, have a longer half-life, and is more susceptible to being oxidized than larger LDL.
3. The reference interval of sdLDL-C levels has been established as <30 mg/dL (0,78 mmol/L). The elevated SdLDL-C levels are associated with elevated triglycerides and low HDL-C.
4. The patients with a predominance of sdLDL-C have a three-fold increased risk of myocardial infarction (MI), while the relative risk is 4.5 for coronary artery disease and 7 for MI when sdLDL-C levels are greater than 100 mg/dL (2,5 mmol/L). The elevated SdLDL-C levels are also associated with increased risk for type 2 diabetes mellitus, obesity, metabolic syndrome (MetS), insulin resistance, renal dysfunction, hepatic steatosis, and dietary trans-fatty acids.
5. Can lower sdLDL-C level by using lipid-lowering drugs such as fibrates, statins, the combination of fibrates and statins, niacin, …, eat a diet very rich in soluble fiber, fewer refined carbohydrates, fewer saturated and trans fats and cholesterol, exercise regularly, well control of blood glucose, and lose excess weight.
*
Bệnh tim mạch (cardiovascular diseases: CVDs) là nguyên nhân gây tử vong số 1 trên toàn thế giới. Có khoảng 17,9 triệu người chết vì CVD năm 2016, chiếm 31% tổng số ca tử vong toàn cầu, trong số đó, 85% là do đau tim và đột quỵ. Hơn ba phần tư số ca tử vong do CVD xảy ra ở các nước thu nhập thấp và trung bình (WHO, 2017).
Bệnh tim mạch là một nhóm các rối loạn của tim và mạch máu, bao gồm: bệnh mạch vành (coronary artery diseases: CAD) như nhồi máu cơ tim (myocardial infarction: MI) và đau thắt ngực (angina pectoris: AP), bệnh mạch máu não (cerebrovascular disease) gây đột quỵ (strock), bệnh động mạch ngoại biên (peripheral artery disease: PAD), … (WHO, 2017).
Xơ vữa động mạch là hiện tượng mảng bám (được tạo thành từ sự lắng đọng cholesterol, các chất béo, chất thải tế bào, calci và fibrin) làm thành mạch dày lên, gây thu hẹp, làm tắc nghẽn các động mạch, làm giảm lưu lượng máu, dẫn đến làm giảm lượng oxy và các chất dinh dưỡng khác đến các mô của cơ thể. Mảng bám có thể ngăn chặn một phần hoặc toàn bộ lưu lượng máu qua các động mạch lớn hoặc trung bình ở tim, não, vùng chậu, chân, cánh tay hoặc thận, có thể dẫn đến các bệnh tim mạch (CVDs). Cơ chế hình thành mảng xơ vữa được thể hiện ở Hình 1.
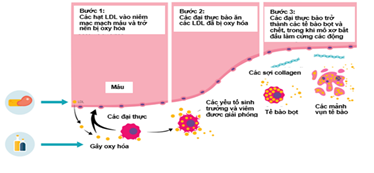
Hình 1. Cơ chế hình thành mảng vữa ở thành động mạch.
Mặc dù mức độ lipoprotein tỷ trọng thấp (low density lipoprotein LDL) thường được coi là một yếu tố nguy cơ quan trọng đối với sự phát triển của bệnh tim mạch, tuy nhiên, nhiều bệnh nhân (có thể đến >75% số bệnh nhân) có mức LDL-C và/ hoặc HDL-C trong huyết tương bình thường vẫn tiến triển hội chứng mạch vành cấp (acute coronary syndrome: ACS) hoặc nhồi máu cơ tim. Sở dĩ có tình trạng này là do LDL có các phân lớp (subclasses) với các kích thước, tỷ trọng và khả năng gây xơ vữa động mạch khác nhau (Bảng 1).
Bảng 1. Đường kính và tỷ trọng của các phân lớp (subclass) của các tiểu phân LDL (Ivanova EA, 2017 [4])
|
Thông số
|
LDL I, lớn
|
LDL II, trung bình
|
LDL III, nhỏ
|
LDL IV, rất nhỏ
|
|
Đường kính (nm)
|
26,0-28,5
|
25,5-26,4 nm
|
24,2-24,6 nm
|
22,0-23,2
|
|
Tỷ trọng (g/mL)
|
1,019-1,023
|
1,023-1,034
|
1,034-1,044
|
1,044-1,060
|
Ghi chú: các hạt LDL lớn, nổi LDL (large floating LDL: lfLDL) thuộc phenotype A = LDL I + LDL II; các hạt LDL nhỏ, đậm đặc (small dense LDL: sdLDL) thuộc phenotype B = LDL III+ LDL IV.
Như vậy, các hạt sdLDL gồm các hạt LDL II và LDL IV, nghĩa là các hạt có đường kính <25,5 nm và tỷ trọng nằm trong khoảng 0,034-1,060.
Trong số các phân lớp của LDL, các hạt sdLDL là một phân lớp có khả năng gây xơ vữa rất mạnh. Sự tăng mức độ SdLDL-C có liên quan đến sự tăng triglyceride và sự giảm HDL-C, béo phì, hội chứng chuyển hóa, đái tháo đường, kháng insulin, rối loạn chức năng thận, gan nhiễm mỡ và acid béo trong chế độ ăn.

Hình 2. Kích thước và tỷ trọng của các phân lớp LDL và HDL
Sở dĩ các hạt sdLDL có khả năng gây xơ vữa cao hơn so với các LDL lớn hơn vì:
- Với kích thước nhỏ, sdLDL có khả năng xâm nhập qua thành động mạch cao hơn,
- Có ái lực với thụ thể LDL thấp hơn,
- Có thời gian bán hủy trong máu dài hơn,
- Dễ bị oxy hóa hơn do chúng có hàm lượng vitamin E thấp hơn, cũng do bề mặt của chúng có hàm lượng cholesterol tự do thấp hơn và hàm lượng acid béo không bão hòa nhiều liên kết đôi (polyunsaturated fatty acids) cao hơn (Hình 3).

Hình 3. Trong số các phân lớp của LDL-C, sdLDL có kích thước nhỏ nên dễ chui qua lớp tế bào nội mô, mang cholesterol đến lớp dưới niêm mạc thành mạch để gây xơ vữa động mạch.
Về số lượng các hạt sdLDL (sdLDL particles), do có kích thước nhỏ hơn nên với cùng một nồng độ LDL-C như nhau, bệnh nhân nào có số lượng sdLDL cao hơn sẽ có nguy cơ bệnh tim mạch cao hơn (Hình 4).

Hình 4. Với cùng một nồng độ LDL-C như nhau (3,25 mmol/L=130 mg/dL), bệnh nhân nào có số lượng sdLDL cao hơn sẽ có nguy cơ bệnh tim mạch cao hơn.
Để đánh giá nguy cơ bệnh tim mạch, thay vì đánh giá số hạt sdLDL, có thể định lượng sdLDL-C vì số số lượng sdLDL-C tương quan thuận rất chặt chẽ với số hạt sdLDL (Hình 5).

Hình 5. Sự tương quan chặt chẽ giữa phương pháp Denka Seiken định lượng sdLDL-C và phương pháp siêu ly tâm tiêu chuẩn vàng (Leary ET, 2016 [7]).
2. Sử dụng của sdLDL-C
- SdLDL-C được sử dụng để đánh giá nguy cơ bệnh tim mạch ở những người có tiền sử cá nhân hoặc gia đình bị bệnh tim mạch sớm, ngay cả khi TC và LDL-C của họ chỉ tăng nhẹ.
- SdLDL-C còn được sử dụng để đánh giá nguy cơ tim mạch ở những người mắc một số bệnh mạn tính như bệnh suy thận mạn, đái tháo đường, hội chứng chuyển hóa, ...
- SdLDL-C cũng có thể được sử dụng để theo dõi hiệu quả điều trị.
- SdLDL-C có thể còn được sử dụng trong nghiên cứu lâm sàng.
3. Chỉ định sdLDL-C
- SdLDL-C có thể được chỉ định để đánh giá nguy cơ bệnh tim mạch ở bệnh nhân có tiền sử cá nhân hoặc gia đình mắc bệnh tim mạch sớm, đặc biệt ở bệnh nhân có mức độ lipid máu bình thường, hút thuốc, béo phì, không hoạt động, tiểu đường và / hoặc tăng huyết áp.
- SdLDL-C còn được chỉ định để theo dõi hiệu quả điều trị hạ lipid hoặc thay đổi lối sống.
- Mặc dù không khuyến nghị chỉ định để sàng lọc, sdLDL-C cùng với các xét nghiệm tim mạch khác vẫn có thể được chỉ định khi nghi ngờ một người có nguy cơ phát triển CVD.
4. Giá trị tham chiếu
- Mức độ sdLDL-C huyết tương ở người khỏe mạnh là <30 mg/dL hay <0,78 mmol/L.
- Mức độ sdLDL-C từ 30 đến 50 mg/dL là giới hạn cao, tuy nhiên, các mức độ sdLDL-C >40 mg/dL và bất kỳ yếu tố nguy cơ nào khác cần đến khám bác sĩ.
- Mức độ sdLDL-C >50 mg/dL cần được điều trị (Ai M, 2018 [1]).
Kỹ thuật định lượng sd LDL-C huyết tương gồm 2 bước (sử dụng hoạt chất để loại bỏ các thành phần lipid khác sdLDL-C, rồi tách chiết cholesterol từ sdLDL-C để định lượng), thực hiện trong 10 phút của Denka Seiken (Nhật Bản) đã được FDA cho phép sử dụng từ 11 năm 2017.
Cũng có thể tính toán mức độ sdLDL-C huyết tương từ non-HDL-C, dLDL-C, and cLDL-C theo công thức:
sdLDL-C (mg/dL) = 0,580 (non-HDL-C) + 0,407 (dLDL-C) – 0,719 (cLDL-C) – 12,05
Trong đó dLDL-C là LDL-C được đo trực tiếp (direct LDL-C) và cLDL-C là LDL-C được tính toán (calculated LDL-C). cLDL-C (mg/dL) = TC – HDL-C – (triglycerides/5).
5. Ý nghĩa lâm sàng
Các nghiên cứu cho thấy những bệnh nhân có sdLDL-C tăng có nguy cơ nhồi máu cơ tim (MI) tăng gấp ba lần, khi nồng độ sdLDL-C lớn hơn 100 mg/ dL có nguy cơ bệnh động mạch vành tăng 4,5 lần và nguy cơ nhồi máu cơ tim tăng 7 lần.
5.1. sdLDL-C ở bệnh nhân bị bệnh mạch vành (coronary artery diseases: CAD)
Trong một nghiên cứu trên 482 bệnh nhân bị bệnh mạch vành (386 nam, 96 nữ) ở mức độ nặng nhẹ khác nhau, Koba S và cộng sự, 2008 [6], thấy rằng, so với các thông số lipid, lipoprotein và apolipoprotein khác, sdLDL-C thể hiện là một yếu tố nguy cơ đối với bệnh mạch vành cao hơn, đặc biệt là ở nam giới (Bảng 2).
Bảng 2. So sánh các thông số lipid, lipoprotein và apolipoprotein ở 482 bệnh nhân bị bệnh mạch vành nhẹ và nặng (Koba S, 2008 [6]).
|
TT
|
Các thông số
|
Bệnh mạch vành, Nam (n=386)
|
Bệnh mạch vành, Nữ (96)
|
|
Nhẹ (n=174)
|
Nặng (n=212)
|
Nhẹ (n=50)
|
Nặng (n=46)
|
|
1
|
TG (mg/dL)
|
127,0 ± 64,3
|
142,7 ± 76,0*
|
113,6 ± 63,9
|
124,2 ± 78,6
|
|
2
|
LDL-C (mg/dL)
|
108,4 ± 26,5
|
122,6 ± 33,1***
|
109,7 ± 31,5
|
118,2 ± 30,6
|
|
3
|
HDL-C (mg/dL)
|
47,3 ± 12,9
|
41,9 ± 11,0***
|
54,6 ± 14,8
|
48,2 ± 14,4
|
|
4
|
Non-HDL-C (mg/dL)
|
134,8 ± 29,0
|
146,2 ± 34,9**
|
135,4 ± 34,1
|
142,1 ± 35,4
|
|
5
|
ApoA-1 (mg/dL)
|
124,7 ± 22,8
|
113,6 ± 21,9***
|
137,4 ± 25,2
|
122,8 ± 26,8*
|
|
6
|
ApoB (mg/dL)
|
86,5 ± 18,4
|
95,9 ± 22,7***
|
85,1 ± 20,1
|
94,7 ± 24,1*
|
|
7
|
sdLDL-C (mg/dL)
|
28,9 ± 15,4
|
39,9 ± 21,3***
|
28,5 ± 16,0
|
38,6 ± 21,8*
|
|
8
|
LDL size (nm)
|
25,60 ± 0,43
|
25,56 ± 0,44
|
25,68 ± 0,34
|
25,59 ± 0,41
|
Ghi chú: *P<0,05; **P<0,01; ***P<0,001.
5.2. sdLDL-C ở bệnh nhân đột quỵ (stroke)
Trong một nghiên cứu trên 530 bệnh nhân bị đột quỵ do thiếu máu cấp (acute ischemic stroke : AIS), trong đó,191 đột quỵ do huyết khối (atheothrombotic), 170 đột quỵ ổ khuyết (lacunar), 162 đột quỵ do nghẽn mạch tim (cardioembolic), 7 đột quỵ do các thiếu máu khác, Manabe Y và cộng sự, 2015 [8], thấy rằng, so với các thông số lipid, lipoprotein và apolipoprotein kacs, sdLDL-C thể hiện là một yếu tố nguy cơ đối với bệnh đột quỵ do thiếu máu cấp cao hơn (Bảng 3).
Bảng 3. Các thông số lipid và lipoprotein ở nhóm đối chứng và nhóm các bệnh nhân đột quỵ do các loại thiếu máu não cấp khác nhau (Manabe Y, 2015 [8]).
|
TT
|
Các thông số
|
Đối chứng (n=50)
|
Đột quỵ do thiếu máu cấp
|
|
Tổng (n=530)
|
Đột quỵ do huyết khối (n=191)
|
Đột quỵ ổ khuyết (n=170)
|
Đột quỵ do nghẽn mạch tim (n=162)
|
Các đột quỵ thiếu máu khác (n=7)
|
|
1
|
TC (mg/dL)
|
183,5±30,4
|
185,1±40,3
|
185,6±35,9
|
193,0±41,7
|
174,7±41,2
|
215,3±44,5
|
|
2
|
TG (mg/dL)
|
87,1±23,5
|
108,0±55,9*
|
111,4±61,2*
|
116,6±60,4*
|
94,0±38,5
|
135,1±73,1*
|
|
3
|
LDL-C (mg/dL)
|
113,9±24,6
|
116,6±33,4
|
117,1±30,0
|
122,1±34,3
|
109,5±35,2
|
136,3±24,1
|
|
4
|
HDL-C (mg/dL)
|
49,1±12,1
|
46,8±12,9
|
46,3±12,3
|
44,6±13,2
|
46,4±13,4
|
51,9±14,0
|
|
5
|
ApoB (mg/dL)
|
90,0±18,4
|
96,2±24,3
|
97,3±23,3
|
99,3±25,3
|
91,1±23,5
|
99,3±25,4
|
|
6
|
LDL/ApoB
|
1,30±0,10
|
1,21±0,15***
|
1,21±0,14***
|
1,23±0,14***
|
1,20±0,18***
|
1,22±0,09***
|
|
7
|
sdLDL (%)
|
32,0
|
59,1***
|
59,2***
|
54,1***
|
63,6***
|
71,4***
|
Ghi chú: *P<0,05; ***P<0,001 so với đối chứng.
5.3. sdLDL trong bệnh mạch ngoại biên (peripheral artery disease)
Bệnh động mạch ngoại biên (peripheral artery disease: PAD) có tỷ lệ lưu hành lên tới 20% ở người cao tuổi. Phần lớn bệnh nhân bị bệnh động mạch ngoại biên không có triệu chứng, do đó, việc điều chỉnh sớm các yếu tố nguy cơ là bắt buộc để giảm tỷ lệ mắc bệnh và tử vong cao liên quan đến bệnh động mạch ngoại biên.
SdLDL-C có liên quan chặt chẽ hơn với độ dày động mạch cảnh (carotid artery intima-media thickness: CA-IMT). Trong một nghiên cứu trên 183 đối tượng khỏe mạnh, độ dày động mạch cảnh được đánh giá bằng siêu âm và nồng độ sdLDL-C được đo bằng xét nghiệm đồng nhất, Shen H và cộng sự, 2015 [10], thấy rằng mức độ sdLDL-C ở nam cao hơn đáng kể so với nữ (p <0,05) và phụ thuộc và tuổi (p <0,05). Khi ảnh hưởng của tuổi, giới và các yếu tố nguy cơ CVD khác được điều chỉnh bằng phân tích hồi quy, độ dày động mạch cảnh vẫn liên quan đáng kể với sdLDL-C (R=0,437, p <0,001).
Ở bệnh nhân bị bệnh động mạch ngoại biên có triệu chứng, việc thông mạch máu qua da là lựa chọn điều trị. Các hạt sdLDL có liên quan nguy cơ biến cố tim mạch. Trong một nghiên cứu trên 64 bệnh nhân bị bệnh động mạch ngoại biên, Jacomella V và công sự, 2014 [5], thấy rằng những bệnh nhân được thông mạch có tỷ lệ các hạt sdLDL thấp hơn (33,1 ± 11,0% so với 39,4 ± 12,1%, p = 0,038) và có kích thước các hạt LDL cao hơn có ý nghĩa so với những người không thông mạch (26,6 ± 1,1 nm so với 26,1 ± 1,1 nm, p = 0,046).
5.4. Giá trị của sdLDL-C trong đánh giá nguy cơ sự kiện tim mạch ở bệnh nhân bệnh thận mạn (chronic kidney disease: CKD)
Trong một nghiên cứu trên 145 bệnh nhân (113 nam và 32 nữ) bị bệnh thận mạn (CKD) giai đoạn 3 và 4, theo dõi trong bốn năm, Shen H và cộng sự, 2016 [11] thấy có 8 bệnh nhân có sự kiện tim mạch gây tử vong và 46 có sự kiện tim mạch không tử vong, các thông số lipid và các phân lớp (subclasses) của LDL-C được chỉ ra ở Bảng 4.
Bảng 4. Giá trị các thông số lipid, lipoprotein và apolipoprotein trong các sự kiện tim mạch ở bệnh nhân suy thận (Shen H, 2016 [11])
|
TT
|
Dấu ấn
|
Không có sự kiện tim mạch (n=91)
|
Có sự kiện tim mạch (n=54)
|
P
|
|
1
|
TC (mg/dL)
|
193,8 ± 34,8
|
183,9 ± 30,4
|
0,085
|
|
2
|
TG (mg/dL)
|
135,3 (93,2-185,6)
|
132 (87,5-176,3)
|
0,982
|
|
3
|
LDL-C (mg/dL)
|
118,6 ± 32,4
|
120,1 ± 30,2
|
0,783
|
|
4
|
HDL-C (mg/dL)
|
47,7 ± 13,2
|
42,3 ± 14,8
|
0,024
|
|
5
|
Non-HDL-C (mg/dL)
|
142,5 ± 35,4
|
142,8 ± 31,8
|
0,959
|
|
6
|
LDL-C/HDL-C
|
2,68 ± 1,06
|
3,11 ± 1,16
|
0,024
|
|
7
|
ApoB (mg/dL)
|
91,6 ± 20,7
|
95,4 ± 37,3
|
0,431
|
|
8
|
ApoA-1 (mg/dL)
|
123,3 ± 22,7
|
111,7 ± 22,7
|
0,003
|
|
9
|
lbLDL-C (mg/dL)
|
83,5 ± 25,2
|
75,2 ± 25,4
|
0,058
|
|
10
|
sdLDL-C (mg/dl)
|
34,7 ± 20,2
|
43,4 ± 26,5
|
0,027
|
|
11
|
sdLDL-C/LDL-C
|
0,29 ± 0,12
|
0,36 ± 0,16
|
0,003
|
|
12
|
eGFR (mL/phút/1,73 m2)
|
53,1 ± 17,7
|
45,6 ± 15,8
|
0,011
|
Phân tích hồi quy đa biến Cox cho thấy sdLDL-C có chỉ số nguy cơ tim mạch HR =1,278, 95% (1,019-1,598) và tỷ số sdLDL-C/LDL-C có nguy cơ tim mạch HR là 2,456, 95 % (1,421–15,784). Phân tích đánh giá sự sống sót Kaplan-Meier cho thấy bệnh nhân có sdLDL-C >38 mg/dL có chỉ số nguy cơ tim mạch logrank =4,375 (P = 0,037) và tỷ lệ sdLDL-C/LDL-C >0,30 có chỉ số tim mạch logrank =11,94 (P = 0,008). Các kết quả chỉ ra rằng ở những bệnh nhân thận mạn có sự liên quan rõ rệt giữa sự tăng sdLDL-C và nguy cơ mắc bệnh tim mạch.
5.5. sdLDL-C ở bệnh nhân đái tháo đường (diabetes mellitus: DM)
Tiền đái tháo đường và đái tháo đường có liên quan một cách có ý nghĩa đến sự phát triển bệnh tim mạch. Trong một nghiên cứu trên 62 người khỏe mạnh và 64 người đái tháo đường, Palazhy S và cộng sự, 2014 [9] thấy rằng, sdLDL-C và một số thông số lipid và apolipoprotein (TG, LDL-C, TG/HDL-C và ApoB) ở bệnh nhân đái tháo đường tăng một cách có ý nghĩa (P<0,05) so với người khỏe mạnh bình thường (Bảng 5).
Bảng 5. So sánh giá trị của các thông số lipid, lipoprotein, apolipoprotein và sdLDL ở bệnh nhân đái tháo đường với người khỏe mạnh (Palazhy S, 2014 [9]).
|
TT
|
Các thông số
|
Đối chứng (n=62)
|
Đái tháo đường (n=64)
|
P
|
|
1
|
TC (mg/dL)
|
168,16±25,64
|
178,81±35,49
|
NS
|
|
2
|
TG (mg/dL)
|
125,19±37,74
|
161,75±36,07
|
<0,05
|
|
3
|
LDL-C (mg/dL)
|
88,5±21,94
|
115,75±30,39
|
<0,05
|
|
4
|
HDL-C (mg/dL)
|
45,08±9,13
|
42,53±9,64
|
NS
|
|
5
|
Apo B (mg/dL)
|
85,45±17,46
|
95,73±17,96
|
<0,05
|
|
6
|
TG/HDL-C
|
2,88±1,06
|
4±1,32
|
<0,05
|
|
7
|
sdLDL (mg/dL)
|
19,76±12,42
|
46,23±10,69
|
<0,05
|
Ghi chú: NS (no significance): không có ý nghĩa thống kê.
5.6. SdLDL-C ở bệnh nhân bị hội chứng chuyển hóa (metabolic syndrome: MetS)
Hội chứng chuyển hóa cũng liên quan một cách có ý nghĩa đến sự phát triển bệnh tim mạch do xơ vữa động mạch (atherosclerotic cardiovascular disease: ASCVD). Fan J và cộng sự, 2019 [3] trong một nghiên cứu trên 297 người khỏe mạnh và 768 bệnh nhân có hội chứng chuyển hóa (vòng bụng nam ≥90 cm và nữ ≥80 cm, TG ≥1,7 mmol/L, HDL-C nam <1,03 mmol/L và nữ <1,30 mmol/L, huyết áp tâm thu ≥130/85 mmHg và nồng độ glucose lúc đói ≥5,6 mmol/L), đã thu được kết quả như được chỉ ra ở Bảng 6.
Bảng 6. Các thông số lipid, lipoprotein và thông số viêm ở bệnh nhân bị hội chứng chuyển hóa (Fan J, 2019 [3])
|
TT
|
Thông số
|
Không HC chuyển hóa (n=297)
|
Có HC chuyển hóa (n=768)
|
P
|
|
1
|
TC (mmol/L)
|
5,37 ± 1,12
|
5,61 ± 1,10
|
0,002
|
|
2
|
TG (mmol/L)
|
1,56 ± 0,96
|
2,92 ± 1,74
|
< 0,001
|
|
3
|
LDL-C (mmol/L)
|
3,58 ± 0,90
|
3,52 ± 0,98
|
0,290
|
|
4
|
HDL-C (mmol/L)
|
1,31 ± 0,26
|
1,11 ± 0,27
|
< 0,001
|
|
5
|
sdLDL-c (mmol/L)
|
0,94 (0,66,1,22)
|
1,23 (0,95,1,50)
|
< 0,001
|
|
6
|
sdLDL-c/LDL-c (%)
|
25,91 (20,64,32,11)
|
34,79 (29,63,41,15)
|
< 0,001
|
|
7
|
hs-CRP (mg/L)
|
1,60 ± 3,31
|
2,25 ± 3,16
|
0,004
|
Các kết quả cho thấy mức độ sdLDL-C cao có liên quan chặt chẽ với sự có mặt của hội chứng chuyển hóa, độc lập với béo bụng và sự viêm (thể hiện bằng mức độ hs-CRP). Ngoài ra, Cho Y và cộng sự, 2015 [2] còn thấy sự tăng triglyceride máu (hypertriglyceridemia) là yếu tố chủ yếu liên quan đến mức độ tăng sdLDL-C ở bệnh nhân có hội chứng chuyển hóa.
6. Điều trị và thay đổi lối sống làm giảm sdLDL-C
Để điều trị nguy cơ bệnh mạch vành, có thể làm giảm sdLDL-C bằng cách sử dụng các thuốc hạ triglyceride (fibrate), hạ cholesterol (statin), kết hợp fibrate và statin, hoặc niacin (vitamin B3).
Trong một nghiên cứu điều trị rosuvastatin với liều 2,5 mg/ ngày trong 12 tuần trên 56 bệnh nhân có lipid máu cao (33 không đái tháo đường và 23 đái tháo đường), Yoshino G và cộng sự, 2012 [12] thấy rosuvastatin có tác dụng làm giảm TC, LDL-C, tỷ số LDL-C/HDL-C và sdLDL-C một cách có ý nghĩa rất rõ rêt (Bảng 7).
Bảng 7. Sự thay đổi mức độ lipid huyết tương của bệnh nhân lipid máu cao (đái tháo đường và không đái tháo đường) trước và sau điều trị rosuvastatin (Yoshino G, 2012 [12]).
|
TT
|
Điều trị rosuvastatin
|
Không đái tháo đường (n=33)
|
Đái tháo đường (n=23)
|
|
Trước
|
Sau
|
Trước
|
Sau
|
|
1
|
TC (mg/dL)
|
268 ± 8
|
202 ± 6***
|
251 ± 9
|
179 ± 6***
|
|
2
|
TG (mg/dL)
|
145 ± 15
|
114 ± 11*
|
178 ± 22
|
139 ± 11
|
|
3
|
LDL-C (mg/dL)
|
176 ± 9
|
115 ± 6***
|
173 ± 21
|
102 ± 6***
|
|
4
|
HDL-C (mg/dL)
|
64 ± 3
|
66 ± 3
|
50 ± 2
|
54 ± 3
|
|
5
|
LDL-C/HDL-C
|
2,9 ± 0,2
|
1,8 ± 0,1***
|
3,5 ± 0,2
|
2,1 ± 0,2***
|
|
6
|
sdLDL-C (mg/dL)
|
57 ± 4
|
31 ± 2***
|
70 ± 5
|
38 ± 3***
|
Ghi chú: *P<0,05, ***P<0,001.
Cũng có thể làm giảm sdLDL-C bằng cách ăn chế độ ăn giàu chất xơ hòa tan, ít carbohydrate tinh chế, ít acid béo bão hòa, ít acid béo dạng trans và cholesterol, tập thể dục thường xuyên, kiểm soát tốt đường huyết và thực hiện giảm cân.
Tài liệu tham khảo
1. Ai M, Yamamoto Y, Toragai R, et al. Reference Range of Serum Concentration of Small Dense Ldl Cholesterol for Health Check-up. Atherosclerosis 2018 June; 32: 55.
2. Cho Y, Lee SG, Jee SH, et al. Hypertriglyceridemia is a Major Factor Associated With Elevated Levels of Small Dense LDL Cholesterol in Patients With Metabolic Syndrome. Ann Lab Med 2015 Nov; 35(6): 586-594.
3. Fan J, Liu Y, Yin S, et al. Small dense LDL cholesterol is associated with metabolic syndrome traits independently of obesity and inflammation. Nutr Metab (Lond.) 2019; 16: 7.
4. Ivanova EA, Myasoedova VA, Melnichenko AA, Grchko AV, and Orekhoov AN. Small Dense Low-Density Lipoprotein as Biomarker for Atherosclerotic Diseases. Oxid Med Cell Longev 2017: 1273042.
5. Jacomella V, Gerber PA, Mosimann K, et al. Small Dense Low Density Lipoprotein Particles Are Associated with Poor Outcome after Angioplasty in Peripheral Artery Disease. PloS One 2014; 9(9): e108813.
6. Koba S, Ykota Y, Hirano T, et al. Small LDL-cholesterol is superior to LDL-cholesterol for determining severe coronary atherosclerosis. J Atheroscler Thromb 2008 Oct; 15(5): 250-260.
7. Leary ET.”AACC Presentation by Pacific Biomarkers”. AACC Annual Scientific Meeting & Clinical Lab Expo; 2016 July 25-27: Chicago, IL.
8. Manabe Y, Morihara R, Matsuzono K, et al. Estimation of the Presence of Small Dense Lipoprotein Cholesterol in Acute Ischemic Stroke. Nerol Int 2015 Mar 23; 7(1): 5973.
9. Palazhy S, Kamath P and Vasudevan D. Estimation of Small, Dense LDL Particles Using Equations Derived From Routine Lipid Parameters as Surrogate Markers. Biochem Anal Biochem 2014; 3: 146.
10. Shen H, Xu L, Lu JF, et al. Correlation between small dense low-density lipoprotein cholesterol and carotid artery intima-media thickness in a healthy Chinese population. Lipids in Health and Disease 2015 Dec; 14: 137.
11. Shen H, Xu Y, Lu J, et al. Small dense low-density lipoprotein cholesterol was associated with future cardiovascular events in chronic kidney disease patients. BMC Nephrology 2016 Dec; 17: 143.
12. Yoshino G, Nakano S, Matsumoto T, et al. Rosuvastatin Reduces Plasma Small Dense LDL-Cholesterol Predominantly in Non-Diabetic Hypercholesterolemic Patients. Pharmacol Pharmacy 2012; 3(1): 72-78.


